草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。
I.某兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)已知CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。
将草酸亚铁分解产生的气体依次通过A(澄清石灰水)和B(氯化钯溶液),观察到A中澄清石灰水变浑浊,B中有黑色物质生成。由此说明气体产物中含有 。
(2)将样品草酸亚铁晶体(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如下图(TG表示残留固体质量占原样品总质量的百分数)。
①试确定B点对应固体物质的化学式 ;
②写出B C对应的化学方程式 。
C对应的化学方程式 。
II.某草酸亚铁样品(不含结晶水)中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。
实验方案如下:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用高锰酸钾溶液滴定至终点。
②向滴定终点混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.02000 mol/L的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 ml。
试回答下列问题:
(1)高锰酸钾标准液用 滴定管盛装(填“酸式”或“碱式”)。
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为 。
(3)在步骤②中,下列操作会引起测定结果偏高的是 。
| A.滴定管在盛装高锰酸钾前未润洗 |
| B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出 |
| C.滴定前读数正确,滴定终点时俯视读数 |
| D.滴定前读数正确,滴定终点时仰视读数 |
(4)0.20g 样品中 FeC2O4的质量分数为 。(不考虑步骤②中的损耗)
实验室利用图④来制乙烯时, 常因温度过高而发生副反应。部分乙醇跟浓硫酸反应生成二氧化硫、二氧化碳、水蒸气和炭黑。请用下列编号为①~④的实验装置设计一个实验, 以验证上述反应后的混合气中含有二氧化碳、二氧化硫和水蒸气。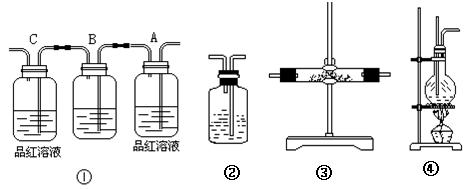
(1)装置③中的固体药品为 ,用以验证的产物是
(2)装置B中的试剂为(填“A、B、C、D”)
A.溴水 B.酸性高锰酸钾溶液 C.NaOH溶液 D.饱和NaHCO3溶液
(3)装置②盛有,可以验证气体的存在。
(4)用装置的编号表示其连接顺序(按气体产物从左到右的流向)④→ ;
;
(5)装置A中的现象是,验证;
(6)装置C中的现象是说明。
(1).电流传感器可以像电流表一样测量电流,不同的是它的反应非常快,可以捕捉到瞬间的电流变化。此外,由于它与计算机相连,能在几秒钟内画出电流随时间变化的图象。在如图a所示的电路中,电源的电动势为6V,先将电键S与1端相连,稳定后,再将电键S从位置1转换到位置2,电容器便通过电阻R放电,这时,电流传感器将电流信息传入计算机,屏幕上便显示出如图b所示的I-t图象。据此,可以估算出电容器的带电量约为 C,电容器的电容量约为μF。(均取一位有效数字)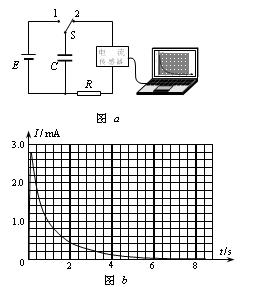
(2)如图为一简易多用表的内部电路原理图,其中G为灵敏电流计,S为单刀多掷电键(功能键),表内两恒压直流电源的电动势不相等,且E1 < E2。由图可知,欲测电压时,应将功能键置于或位置;欲测电阻时,应将功能键置于或位置。在测电流的两个位置中,将功能键置于位置时电流的量程较大;在测电阻的两个位置中,将功能键置于位置时所选的倍率较大。(统一填写功能键序号)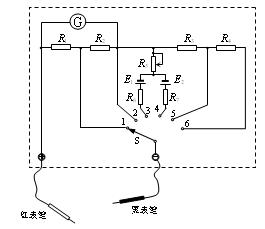
某同学设计了一个用单摆的实验装置验证机械能守恒的实验如图所示 通过光控门,可以从时间显示仪上读小球挡光的时间。他的实验步骤是: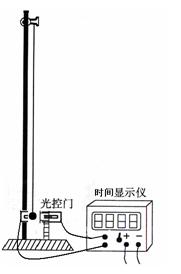
①用刻度尺测出摆线长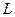 ,再用游标卡尺测量摆球的直径如图所示。
,再用游标卡尺测量摆球的直径如图所示。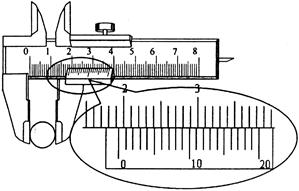
②将摆球拉离平衡位置使得摆球的高度升高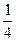 摆长,闭合时间显示仪开关,由静止释放摆球,从时间显示仪读出摆球挡光时间
摆长,闭合时间显示仪开关,由静止释放摆球,从时间显示仪读出摆球挡光时间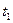 。
。
③断开时间显示仪开关,撤去光控门,将摆球拉离平衡位置一个很小的角度(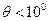 ),由静止释放摆球,用秒表测出摆球作N次全振动的时间是
),由静止释放摆球,用秒表测出摆球作N次全振动的时间是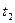
回答:摆球的直径是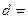 cm
cm
用秒表测出摆球作N次全振动的时间时应在摆球经过时开始计时,当地的重力加速度是(用字母表示各物理量)
在误差允许的范围内得到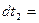 (用字母表示各物理量),就验证了摆球运动过程中机械能守恒。
(用字母表示各物理量),就验证了摆球运动过程中机械能守恒。
为减小误差,在体积相同的条件下,摆球应选用实心金属球。
某研究性学习小组查阅资料得知:漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(C1O)2+CaCl2+H2SO4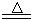 2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。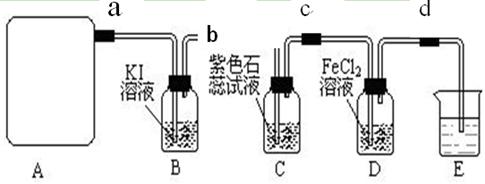
试回答下列问题:
(1)每生成1 mol Cl2,上述化学反应中转移的电子个数为______ (NA表示阿伏加德罗常数)。
(2)该实验中A处可选用装置__________ _____(填写甲.乙.丙或丁)。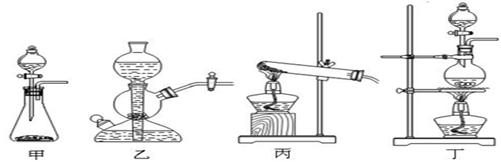
(3)检查A装置的气密性的方法是用弹簧夹夹住处(填a.b.c或d)橡皮管,向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静止观察,当观察到分液漏斗中时,表明该装置不漏气 。
(4)装置B中发生反应的离子方程式为_____________________。
(5)装置C中的现象为____________________________________。
(6)装置E中的试剂是______________(任填一种合适试剂的名称),
其作用是______________________________
(7)请帮助该学习小组同学设计一个实验,证明装置D中有FeCl3生成(请简述实验 步骤)
步骤)
___________________________________________________________
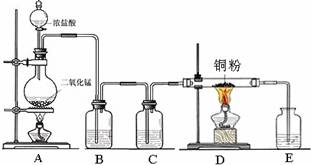
实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移的方向和数目
。
(2)B处盛有饱和食盐水(或水),其作用是。
(3)C处盛放的试剂__________(填名称),其作用是。
(4)E处盛有_______(填名称),发生反应的离子方程式为。
(5)实验结束时,应先熄灭__________处酒精灯。