(1).电流传感器可以像电流表一样测量电流,不同的是它的反应非常快,可以捕捉到瞬间的电流变化。此外,由于它与计算机相连,能在几秒钟内画出电流随时间变化的图象。在如图a所示的电路中,电源的电动势为6V,先将电键S与1端相连,稳定后,再将电键S从位置1转换到位置2,电容器便通过电阻R放电,这时,电流传感器将电流信息传入计算机,屏幕上便显示出如图b所示的I-t图象。据此,可以估算出电容器的带电量约为 C,电容器的电容量约为 μF。(均取一位有效数字)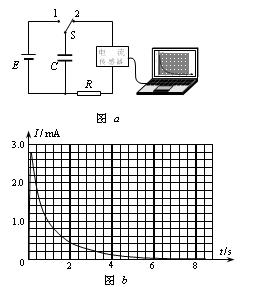
(2)如图为一简易多用表的内部电路原理图,其中G为灵敏电流计,S为单刀多掷电键(功能键),表内两恒压直流电源的电动势不相等,且E1 < E2。由图可知,欲测电压时,应将功能键置于 或 位置;欲测电阻时,应将功能键置于 或 位置。在测电流的两个位置中,将功能键置于位置 时电流的量程较大;在测电阻的两个位置中,将功能键置于位置 时所选的倍率较大。(统一填写功能键序号)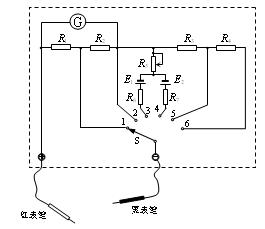
某化学学习小组设计下图实验装置(夹持装置略去)制备Cl2,并探究氯气的相关性质。
(1)若A装置中固体药品为KClO3,则反应中每生成1 mol Cl2时转移电子的物质的量为____________mol。
(2)装置B的作用______________。
(3)装置C的作用是验证氯气是否具有漂白性,I处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是__________________、____________________。
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。请简述能说明氯、溴、碘非金属性强弱的实验操作及现象:_______________________。
(5)请用化学方程式说明装置F的作用:_____________________。
(6)甲同学提出,装置F中的试剂可改用足量的Na2SO3溶液,乙同学认真思考后认为此法不可行。请用离子方程式解释乙认为不可行的原因:_________________。
下列是某化学小组为探究氢氧化钙的性质而进行的相关实验,请你也一起参与探究。
(1)小明通过一玻璃管向盛有澄清石灰水的试管中吹气,溶液变浑浊
(2)小丽向盛有澄清石灰水的试管中加入适量的碳酸钠溶液,溶液变浑浊。
(3)小倩向盛有少量氢氧化钙固体的试管中加入一定量的蒸馏水,液体变浑浊,再向其中加入3滴无色酚酞,液体变成红色,继续向试管中加入过量的稀盐酸,出现的现象是 ,据小倩同学的实验及现象可知氢氧化钙具有的性质有 。
(4)上述实验涉及的反应不属于碱的相似化学性质的反应方程式是 ,不属于基本反应类型的反应方程式是 。
(5)实验后三位同学将试管中的废液倒入同一烧杯中,搅拌,得到无色溶液,则该溶液中一定含有的物质是 。请设计实验证明可能存在的物质是否存在:
| 实验步骤 |
实验现象及结论 |
已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
(1)A分子中官能团的名称是 ,反应①的化学反应类型是 反应。
(2)反应④的化学方程式是 。
(3)某同学用如图所示的实验装置制取少量乙酸乙酯。
实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①实验开始时,试管甲中的导管不伸入液面下的原因是 。
②若分离出试管甲中该油状液体需要用到的仪器是________(填序号)。
a.漏斗 b.分液漏斗 c.长颈漏斗
③实验结束后,若振荡试管甲,会有无色气泡生成,其主要原因是 (结合化学方程式回答)。
(16分)氮化铝(AlN)陶瓷是一种类金刚石氮化物的新型无机非金属材料,最高可稳定到2200°C,导热性好,热膨胀系数小,是良好的耐热冲击材料。抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料。工业用氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。现要通过实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①已知Al4C3与硫酸反应可生成CH4,则该反应的离子方程式是______________。
②AlN溶于强酸生成铵盐,溶于氢氧化钠溶液生成氨气,请写出AlN与NaOH溶液反应的化学方程式___________。
(2)实验装置(如下图所示)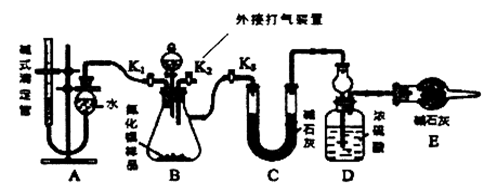
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL。
②称取xgAlN样品置于锥形瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入过量____(填化学式),与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3,通过分液漏斗加入过量 _______(填化学式),与锥形瓶内物质充分反应。
④打开K2,通过打气装置通入空气一段时间。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据处理与问答
①在上述装置中,设置活塞K2的目的是__________。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积_________(填“偏大”,“偏小”或“无影响”)。
③Al4C3的质量分数为 ____,AlN的质量分数为_______。
(10 分)请你参与下列探究:
[问题情景]某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出。同学们都能解释红色固体物质的出现,请你写出生成红色固体物质的化学反应方程式 。但却对气体的生成产生了疑问,这激发了同学们强烈的探究欲望,生成的是什么气体?
[提出猜想]从物质组成元素的角度,放出的气体可能是O2、SO2、H2。
[查阅资料]SO2易溶于水,它能与过量的 NaOH 溶液反应,生成 Na2SO3。
[方案设计]依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则较简单的检验方法是 。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有 NaOH 溶液的洗气瓶中,称量通气前后洗气瓶的质量。写出SO2与过量的 NaOH溶液反应的化学方程式 。
(3)甲、乙同学实验的结果表明气体中既不含O2也不含SO2。丙同学根据以上实验结果推测气体是H2。 [实验探究]丙同学为了检验H2,收集了一试管气体,用拇指堵住试管口且管口略向下倾斜靠近火焰移开拇指点火,听到很小的声音。然后再将气体用带尖嘴的导管导出点燃且用冷而干燥的烧杯罩在火焰上方,气体在空气中安静的燃烧,产生淡蓝色火焰,烧杯壁上有水珠生成,接触烧杯的手能感觉到发热。 结论:铁粉与硫酸铜的溶液反应时,产生的气体是 。
[实验探究]丙同学为了检验H2,收集了一试管气体,用拇指堵住试管口且管口略向下倾斜靠近火焰移开拇指点火,听到很小的声音。然后再将气体用带尖嘴的导管导出点燃且用冷而干燥的烧杯罩在火焰上方,气体在空气中安静的燃烧,产生淡蓝色火焰,烧杯壁上有水珠生成,接触烧杯的手能感觉到发热。 结论:铁粉与硫酸铜的溶液反应时,产生的气体是 。
[思维拓展]由上述实验可以推出,硫酸铜溶液中可能含有_________物质。