(10 分)请你参与下列探究:
[问题情景]某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出。同学们都能解释红色固体物质的出现,请你写出生成红色固体物质的化学反应方程式 。但却对气体的生成产生了疑问,这激发了同学们强烈的探究欲望,生成的是什么气体?
[提出猜想]从物质组成元素的角度,放出的气体可能是O2、SO2、H2。
[查阅资料]SO2易溶于水,它能与过量的 NaOH 溶液反应,生成 Na2SO3。
[方案设计]依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则较简单的检验方法是 。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有 NaOH 溶液的洗气瓶中,称量通气前后洗气瓶的质量。写出SO2与过量的 NaOH溶液反应的化学方程式 。
(3)甲、乙同学实验的结果表明气体中既不含O2也不含SO2。丙同学根据以上实验结果推测气体是H2。
 [实验探究]丙同学为了检验H2,收集了一试管气体,用拇指堵住试管口且管口略向下倾斜靠近火焰移开拇指点火,听到很小的声音。然后再将气体用带尖嘴的导管导出点燃且用冷而干燥的烧杯罩在火焰上方,气体在空气中安静的燃烧,产生淡蓝色火焰,烧杯壁上有水珠生成,接触烧杯的手能感觉到发热。 结论:铁粉与硫酸铜的溶液反应时,产生的气体是 。
[实验探究]丙同学为了检验H2,收集了一试管气体,用拇指堵住试管口且管口略向下倾斜靠近火焰移开拇指点火,听到很小的声音。然后再将气体用带尖嘴的导管导出点燃且用冷而干燥的烧杯罩在火焰上方,气体在空气中安静的燃烧,产生淡蓝色火焰,烧杯壁上有水珠生成,接触烧杯的手能感觉到发热。 结论:铁粉与硫酸铜的溶液反应时,产生的气体是 。
[思维拓展]由上述实验可以推出,硫酸铜溶液中可能含有_________物质。
酸碱中和滴定是中学化学常见实验。
某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
| A.冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。 |
| B.量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。 |
C.将酸式滴定管和碱式滴定管 用蒸馏水洗涤干净,并用各待盛溶液润洗。 用蒸馏水洗涤干净,并用各待盛溶液润洗。 |
| D.将物质的量浓度为1.50mol·L-1标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。 |
E.继续滴定至终点,记下读数为V2。
F.在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G.量取浓硫酸样品5mL,在烧杯中用蒸馏水溶解。
H.重复以上实验。
请回答下列问题:
(1)操作步骤的顺序为 → A→ → →D→ → → H(用字母填写)。
(2)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(3)选用的指示剂是 。
(4)判断到达滴定终点的现象是 。
(5)下表是实验测得的有关数据:
| 滴定 序号 |
待测稀硫酸 的体积(mL) |
所消耗NaOH标准溶液液的体积(mL) |
|
| V1 |
V2 |
||
| ① |
20.00 |
0.50 |
22.60 |
| ② |
20.00 |
6.00 |
27.90 |
请计算出该浓硫酸样品的浓度为 mol·L-1(不必写出计算过程)。
“阳光”牌小包装“脱氧剂”成份为Fe粉、活性炭及少量NaCl、水,使用一段时间后Fe粉会变质。某校化学兴趣小组欲探究使用过的 “脱氧剂”的变质程度(已变质的Fe粉占变质前Fe粉的质量分数),设计并进行了如下探究过程,请你参与实验并回答有关问题。
步骤⑴取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末。由此得出的结论为上述“脱氧剂”中的铁已变质,发生了腐蚀,生成的铁锈主要成分是(填化学式);
步骤⑵将步骤⑴中的固体溶于水,过滤,将滤渣洗涤、干燥。该步骤的目的是;
步骤 ⑶ 取步骤⑵中的滤渣,将其分为两等份,每一份质量为8.0g。将其中一份在氧气流中充分灼烧,生成的气体全部通入足量的澄清石灰水,得到干燥、纯净的沉淀20.0g。据此计算8.0g滤渣中活性炭的质量为;
⑶ 取步骤⑵中的滤渣,将其分为两等份,每一份质量为8.0g。将其中一份在氧气流中充分灼烧,生成的气体全部通入足量的澄清石灰水,得到干燥、纯净的沉淀20.0g。据此计算8.0g滤渣中活性炭的质量为;
步骤⑷ 将步骤⑶中的另一份滤渣放入烧杯中,加入一定体积2.0mol/L的稀H2SO4,微热至反应完全。为保证滤渣充分溶解,加入的稀H2SO4的体积应大于或等于mL;
步骤⑸ 向步骤⑷中的混合物中加入过量的氢氧化钠溶液,得到的固体经洗涤后转移到坩埚中充分加热 ,冷却、称量,得到6.86g固体。
,冷却、称量,得到6.86g固体。
结论:该“脱氧剂”中的Fe粉的变质程度为。
为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气 体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。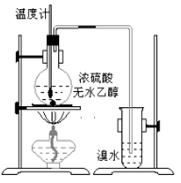
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,超过170℃后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:
⑴写出甲同学实验中两个反应的化学方程式:
、
。
⑵乙同学观察到的黑色物质是,刺激性气体是。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):_____________________。
⑶丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。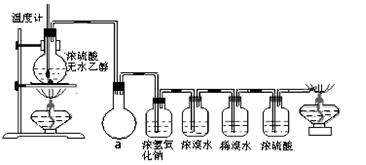
①设计装置a的作用是。
②浓溴水的作用是,
稀溴水的作用是。
.请利用下列装置及试剂组装一套装置。其流程是,先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。试回答:

(1)按气体从左向右流向将各装置依次连接起来(填接口标号): a 接_______,______
接______ ,______ 接______ ,______ 接______ ,______ 接h。
(2)烧瓶中发生反应的化学方程式是________________________________________ 。
(3)D装置的作用是____________________ ,E装置的作用是____________________ ,
F装置的作用 是 ________________________。
是 ________________________。
(4)C瓶中的现象是______________________ ,B瓶中的现象是___________________ 。以上事实说明起漂白作用的物质是___________________ 。
.下图为两套实验装置。
(1)写出下列仪器的名称:
① ___________;② ____________。
(2)仪器①~④中,使用时必须检查是否漏水的有。(填序号)
(3)若利用装置I制取蒸馏水,还缺少的仪器有 _____,将仪器补充完整后进行的;实验操作的名称为:,冷却水从口进。
(4)现需配制250 mL 0.2 mol·L—1 NaCl溶液,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是,。