“阳光”牌小包装“脱氧剂”成份为Fe粉、活性炭及少量NaCl、水,使用一段时间后Fe粉会变质。某校化学兴趣小组欲探究使用过的 “脱氧剂”的变质程度(已变质的Fe粉占变质前Fe粉的质量分数),设计并进行了如下探究过程,请你参与实验并回答有关问题。
步骤⑴取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末。由此得出的结论为上述“脱氧剂”中的铁已变质,发生了 腐蚀,生成的铁锈主要成分是 (填化学式);
步骤⑵将步骤⑴中的固体溶于水,过滤,将滤渣洗涤、干燥。该步骤的目的是 ;
步骤 ⑶ 取步骤⑵中的滤渣,将其分为两等份,每一份质量为8.0g。将其中一份在氧气流中充分灼烧,生成的气体全部通入足量的澄清石灰水,得到干燥、纯净的沉淀20.0 g。据此计算8.0 g滤渣中活性炭的质量为 ;
⑶ 取步骤⑵中的滤渣,将其分为两等份,每一份质量为8.0g。将其中一份在氧气流中充分灼烧,生成的气体全部通入足量的澄清石灰水,得到干燥、纯净的沉淀20.0 g。据此计算8.0 g滤渣中活性炭的质量为 ;
步骤⑷ 将步骤⑶中的另一份滤渣放入烧杯中,加入一定体积2.0mol/L的稀H2SO4,微热至反应完全。为保证滤渣充分溶解,加入的稀H2SO4的体积应大于或等于 mL;
步骤⑸ 向步骤⑷中的混合物中加入过量的氢氧化钠溶液,得到的固体经洗涤后转移到坩埚中充分加热 ,冷却、称量,得到6.86g固体。
,冷却、称量,得到6.86g固体。
结论:该“脱氧剂”中的Fe粉的变质程度为 。
(本题共12分)下图是实验室制备1,2—二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)。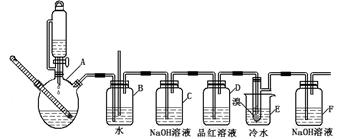
有关数据列表如下:
请完成下列填空:
41.A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:__________________。
42.气体发生装置使用连通滴液漏斗的原因_____________________________________。
43.请写出C装置中的离子反应方程式_______________________________________。
44.装置D中品红溶液的作用是__________________________________;
45.反应过程中应用冷水冷却装置E,其主要目的是___________________________;但又不能过度冷却(如用冰水),其原因是____________________________________。
46.学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是______________。
47.有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,判断改用四氯化碳液体是否可行______(填“是”或“否”),其原因是__________________________。
(13分)某小组对Cu与浓HNO3的反应进行研究。记录如下:
I.Cu与浓HN03反应的化学方程式是 。
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(1)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是 。
(2)乙认为溶液呈绿色是由溶解的NO2引起的。进行实验2:先将NO2通入B中,再鼓入N2。结果证实假设成立。则以上两步操作对应的现象分别是
、 。
(3)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的、浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O =HNO3+HNO2HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii.NO—2能与Cu2+反应:Cu2+(蓝色)+4 NO2- Cu(NO2)42-(绿色)
Cu(NO2)42-(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了Cu(NO2)2—4使溶液呈绿色。
丙进行如下实验: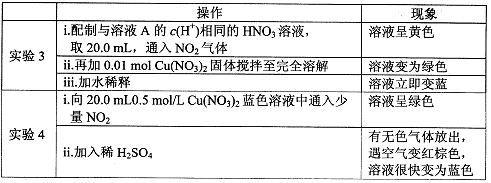
①亚硝酸分解的化学方程式是 。
②请用平衡原理解释加入稀H2SO4后绿色溶液变蓝的原因 。
(4)根据实验得出结论:实验l中溶液A呈绿色的主要原因是 ,请依据实验现象阐述理由: 。
某学生查阅资料得知溴乙烷的物理性质与制取方法如下表: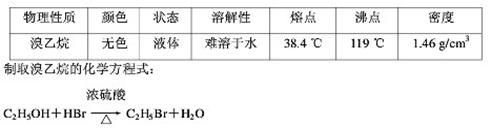
联想到所学溴苯的制取,他设计了制取溴苯和溴乙烷的装置I,主要实验步骤如下:
①检查气密性后,向烧瓶中加入一定量的苯和液溴。
②向锥形瓶中加入乙醇和浓硫酸的混合液至恰好于进气导管口。
③将A装置中的纯铁丝向下插入混合液中。
④点燃B装置中酒精灯,用小火缓缓对锥形瓶加热10min.请填写下列空白:
(1)A中发生反应的方程式
(2)装置长导管a的作用是
(3)C装置中的U形管内用蒸馏水封住管底的作用是
(4)反应完毕后,U形管内的现象是 分离出溴乙烷时所用的最主要的仪器名称是 (只填一种)
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生反应的化学方程式是 。B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请解释原因 。
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是 (生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。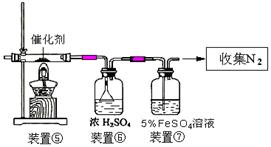
请回答:装置⑦的作用可能是 ;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是 。
5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
| 阳离子 |
Na+Al3+Fe3+ Cu2+Ba2+ |
| 阴离子 |
OH-Cl-CO32-NO3-SO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6 mol·L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A、C的化学式为:A ;C 。
(2)写出步骤②中发生反应的化学方程式 。
(3)D溶液中滴入石蕊试液,现象是 ,
原因是 (用离子方程式说明)。
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是 mL。