在容积一定的密闭容器中发生可逆反应:A(g)+2B(g) 2C(g) △H>O,其他条件不变,只有温度改变时,某量随温度变化的关系如图所示。则下列说法正确的是
2C(g) △H>O,其他条件不变,只有温度改变时,某量随温度变化的关系如图所示。则下列说法正确的是
| A.P1>P2,纵坐标可表示A的质量分数 |
| B.P1 <P2,纵坐标可表示C的质量贫数 |
| C.P1>P2,纵坐标可表示混合气体的平均摩尔质量 |
| D.P1<P2,纵坐标可表示A的转化率 |
已知反应:CO(g)  C(s)+
C(s)+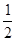 O2(g)的H为正值,△S为负值。设H和△S不随温度而变化,下列说法中正确的是( )
O2(g)的H为正值,△S为负值。设H和△S不随温度而变化,下列说法中正确的是( )
| A.低温下是自发变化 | B.高温下是自发变化 |
| C.低温下是非自发变化,高温下是自发变化 | D.任何温度下都是非自发变化 |
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
| A.该合金中铜与镁的物质的量之比是2∶1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 ml |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A.62gNa2O溶于水后所得溶液中含有的O2-数为NA |
| B.标准状况下,NA个三氧化硫分子所占据的体积约是22.4L |
| C.常温常压下,16g甲基(—13CH3)所含的中子数为7NA |
D.10L0.1mol·L-1的Na2CO3溶液中,Na+、CO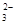 总数为3NA 总数为3NA |
用下列实验装置进行相应实验,能达到实验目的的是( )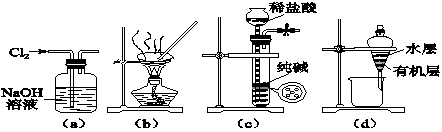
| A.用图(a)所示装置除去Cl2中含有的少量HCl |
| B.用图(b)所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| C.用图(c)所示装置制取少量纯净的CO2气体 |
| D.用图(d)所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
已知下图表示向某I—和Cl—的混合稀溶液中滴加AgNO3溶液时,产生的沉淀质量m(沉淀)与加入的AgNO3溶液体积V(AgNO3)之间的关系。由此可知原溶液中c(I—) / c(Cl—)的比值为 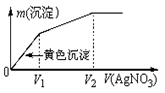
| A.(V2-V1) / V1 | B.V1 / V2 |
| C.V1 / (V2-V1) | D.V2 / V1 |