下列有关电解质溶液说法都正确的是
| A.将10ml0.1mol·L-1Na2CO3溶液逐滴滴加到10ml0.1mol·L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) |
| B.物质的量浓度相等的NaF溶液和CH3COONa溶液相比较,两者离子的总浓度相等 |
| C.向0.1 mol·L-1 FeCl3溶液中滴加少量酸性KMnO4溶液,KMnO4 溶液不褪色,说明FeCl3溶液只有氧化性,无法被氧化剂氧化 |
| D.把AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3的溶液,可观察到大量淡黄色沉淀与少量白色沉淀生成,说明反应后AgCl与AgBr沉淀应都有,但是以AgBr为主,说明Ksp(AgCl)>Ksp(AgBr) |
一定条件下合成乙烯: 6 H2(g) +2CO2(g) CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是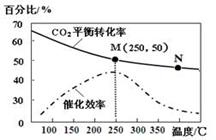
| A.生成乙烯的速率:v(M)一定小于v(N) |
| B.化学平衡常数:KN>K M |
| C.当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低 |
| D.若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
常见的无机酸25℃时在水溶液中的电离平衡常数如下表,下列选项正确的是
| 氢氰酸(HCN) |
碳酸(H2CO3) |
氢氟酸(HF) |
| K = 6.2×10-10 |
Ka1= 4.2×10-7 |
K=6.61×10-4 |
A.氟化钠溶液中通入CO2:2F-+H2O+CO2=2HF+CO32-
B.NaCN与HCN的混合溶液中:2c(Na+) = c(CN-)+ c(HCN)
C.0.2mol•L-1HCN溶液与0.1mol•L-1NaOH溶液等体积混合后,溶液的pH>7
D.25℃时同浓度的NaCN和NaF溶液的pH值前者小于后者
在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失.下列判断不正确的是
| A.氧化性:ClO﹣>I2>SO42﹣ |
| B.漂白粉溶液可使淀粉碘化钾试纸变蓝 |
| C.次氯酸钠可以与亚硫酸钠共存 |
| D.向氯水中加入亚硫酸钠溶液,氯水褪色 |
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1﹣xCoO2 C6+LiCoO2.下列说法不正确的是
C6+LiCoO2.下列说法不正确的是
| A.据题意分析可知该隔膜只允许Li+通过,放电时 Li+从左边流向右边 |
| B.充电时,A为阴极,发生还原反应 |
| C.放电时,B为正极,电极反应式为:Li1﹣xCoO2+xLi++xe﹣=LiCoO2 |
| D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
下列表示化学反应的离子方程式,其中正确的是
A.NH4HSO3溶液与足量NaOH溶液共热:NH4++HSO3-+2OH- NH3↑+SO32-+2H2O NH3↑+SO32-+2H2O |
| B.向氯化铝溶液中加入过量氨水:Al3+ + 4NH3·H2O ="=" AlO2- + 4NH4+ +2H2O |
| C.用盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2 MnO4-+6H++ 5H2O2==2Mn2++5 O2 ↑+ 8H2O |
D.用石墨电极电解饱和MgCl2溶液:2Cl-+2H2O  H2↑+ Cl2↑ + 2OH- H2↑+ Cl2↑ + 2OH- |