在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向。如果电动汽车上使用新型钒电池,一次性充电3—5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的1/25和1/10。全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示: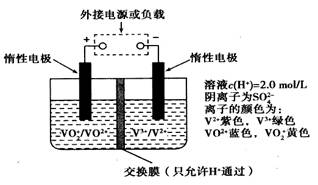
下列有关该钒电池的说法不正确的是:
| A.该电池为可逆电池, 当左槽溶液逐渐由黄变蓝时,为充电过程,此时左槽溶液pH值升高 |
| B.放电过程中,右槽溶液中溶液颜色由紫色变为绿色 |
| C.充电过程中, H+可以通过质子交换膜向右移动,形成电流通路,并且参与电极反应 |
D.充电时若转移的电子数为3.01 1023个,左槽溶液中n(H+)增加了0.5mol 1023个,左槽溶液中n(H+)增加了0.5mol |
下列说法中正确的是
| A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足8电子稳定结构 |
| B.P4和CH4都是正四面体形分子且键角都为109°28′ |
C.NH4+的电子式为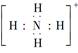 ,离子呈平面正方形结构 ,离子呈平面正方形结构 |
| D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 |
氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2―→2HCl +2COCl2。下列说法不正确的有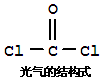
| A.CHCl3分子的空间构型为正四面体 |
| B.COCl2分子中中心C原子采用sp2杂化 |
| C.COCl2分子中所有原子的最外层电子都满足8电子稳定结构 |
| D.使用前可用硝酸银稀溶液检验氯仿是否变质 |
“莫斯科2009年7月28日电,27日夜间,位于莫斯科郊外的杜伯纳国际联合核研究所的专家们启动新元素合成实验,如果顺利的话,实验结束时将会合成门捷列夫元素周期表上的第117号新元素”。下列有关该元素的说法正确的是
| A.117 g该元素原子的物质的量为1 mol |
| B.该元素一定为非金属元素 |
| C.该元素在地球上的含量十分丰富 |
| D.该元素的金属性可能比非金属性更明显 |
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是
| 元素 |
I1 |
I2 |
I3 |
I4 |
| X |
500 |
4600 |
6900 |
9500 |
| Y |
580 |
1800 |
2700 |
11600 |
A.元素X的常见化合价是+1
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
下列表述不正确的是
| A.福岛核电站泄露的放射性物质131I与127I互为同位素,化学性质几乎相同 |
| B.电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述 |
| C.除去SO2中混有的少量HCl,使气体通过盛有饱和NaHSO3溶液的洗气瓶 |
| D.为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性 |