开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物直接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K= ;
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
③工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是: 。
(2)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
①请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
(3)Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-1gc(Clˉ)]
①下列说法中正确的是 。
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释
B.当c(C1ˉ) =10ˉ1 mol·Lˉ1时,汞元素一定全部以HgCl42ˉ形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl+ + C1ˉ
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是 (填晶体类型)。
Ba2+是一种重金属离子,有一环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的物质的量浓度。
(1)在容量瓶的使用方法中,下列操作不正确的是(填字母)________。
| A.使用容量瓶前检查它是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液润洗 |
| C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近标线1~2 cm处,用滴管逐滴滴加蒸馏水至标线 |
| D.配制溶液时,若试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加水至接近标线1~2 cm处,用滴管逐滴滴加蒸馏水至标线 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(2)现需配制250 mL 0.100 mol·L-1的标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250 mL容量瓶、玻璃棒外,还需要________________。
(3)需准确称取Na2S2O3固体的质量为________g。
(4)另取废水50.00 mL,控制适当的酸度,加入足量的K2Cr2O7溶液,得到BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加入过量KI溶液进行反应,然后在反应液中滴加上述标准Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00 mL。已知有关反应的离子方程式为①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;②I2+2S2O32-=2I-+S4O62-。则该工厂废水中Ba2+的物质的量浓度为________。
2014年全运会在辽宁举办,其开幕式就是一场焰火盛宴。
(1)焰火利用了部分金属元素特征的反应,该反应属于(填“物理”或“化学”)变化。
(2)如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素组成,每种化合物仅含两种元素。
图中A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E分子结构的球棍模型为 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为,D的化学式是。
②A、B、E中均含有的一种元素符号为。
③C与纯碱反应的化学方程式为。
④液态B与液态E反应可生成一种单质和一种常见液体,1 mol B参加反应放出热量Q kJ,其反应的热化学方程式为。
半透膜与滤纸一样有许多小孔,但孔径比滤纸小,只能通过较小的离子和分子,胶体分散质不能通过半透膜。现把10 mL淀粉胶体和5 mL KCl溶液的混合液体加入用半透膜制成的袋内,将此袋浸入烧杯内的蒸馏水中。2 min后,用两支试管各取5 mL烧杯中的液体,并做如下实验。
(1)向其中一支试管里滴加少量AgNO3溶液,其现象是。
(2)用另一支试管里的溶液设计实验,证明胶体粒子是否存在?。
(3)由上述实验得出的结论是。
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+CCl4(g) TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
有关物质性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
其他 |
| CCl4 |
-23 |
76 |
与TiCl4互溶 |
| TiCl4 |
-25 |
136 |
遇潮湿空气产生白雾 |
仪器A的名称是________。装置E中的试剂是________。反应开始前依次进行如下操作:组装仪器、________、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2 ②熄灭酒精灯 ③冷却至室温。正确的顺序为________(填序号)。欲分离D中的液态混合物,所采用操作的名称是________。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶 FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解 TiOSO4(aq)+2H2O(l)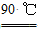 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
简要工艺流程如下: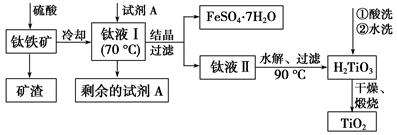
①试剂A为________。钛液Ⅰ需冷却至70 ℃左右,若温度过高会导致产品TiO2产率降低,原因是__________________________________________
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是________。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是____________________(填化学式)。
兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示: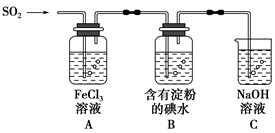
(1)SO2气体还原Fe3+的产物是________(填离子符号),参加反应的SO2和Fe3+的物质的量之比是________。
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧D.铜与热浓H2SO4
(3)装置C的作用是________________________________________________。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有________(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D .烧杯
E.玻璃棒F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是________________________________
(6)能表明I-还原性弱于SO2的现象是________________________________