某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为( )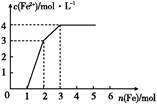
| A.1∶1∶1 | B.1∶3∶1 | C.3∶3∶8 | D.1∶1∶4 |
某有机物结构简式如图,关于该有机物叙述错误的是()
| A.1 mol该物质在加热和催化剂作用下,最多能和4 mol H2发生加成反应 |
| B.能使溴水褪色也能使酸性KMnO4溶液褪色 |
| C.遇硝酸银溶液产生白色沉淀 |
| D.在一定条件下,能发生取代反应 |
化学中图象可以直观地描述化学反应的进程或结果,下列图像描述正确的是()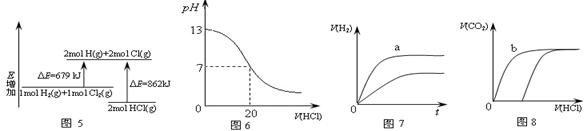
| A.图5表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H =183kJ·mol-1 |
| B.图6表示室温时用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液,溶液pH随加入酸体积变化 |
| C.图7表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
| D.图8表示10mL0.1mol/LNa2CO3和NaHCO3两种溶液中,分别滴加0.1mol/LHCl,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |
在密闭容器中发生下列反应aA(g)  cC (g) + dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是()
cC (g) + dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是()
| A.A的转化率变大 | B.a < c + d |
| C.平衡向正反应方向移动 | D.D的体积分数变大 |
微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别为Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e- = ZnO+H2O, Ag2O+H2O+2e- =2Ag+2OH-,总反应式为:Ag2O+ Zn = 2Ag+ZnO。根据上述反应式,下列说法正确的是()
| A.在使用过程中,电池负极区溶液的碱性增强 |
| B.使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C.Zn是负极,Ag2O是正极 |
| D.Zn电极发生还原反应,Ag2O电极发生氧化反应 |
某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则( )
C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则( )
| A.a=3 | B.a=2 |
| C.B的转化率为40% | D.B的转化率为60% |