二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料(见下图)。下列说法正确的是( )
| A.SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物 |
| B.SiO2和Si都是光导纤维材料 |
| C.在硅胶中加入CoCl2可显示硅胶吸水是否失效 |
| D.图中所示转化反应都是非氧化还原反应 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是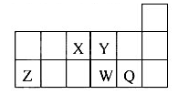
A 元素X与元素Z的最高正化合价之和的数值等于8
B 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D 元素W的最高价氧化物对应的水化物的酸性比Q的强
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
依据元素周期表及元素周期律,下列推断正确的是
| A.H3BO3的酸性比H2CO3的强 |
| B.Mg(OH)2的碱性比Be(OH)2的强 |
| C.HCl、HBr、HI的热稳定性依次增强 |
| D.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则
| A.原子半径:丙>丁>乙 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均为共价化合物 |
| D.乙、丙、丁的最高价氧化物对应的水化物不能相互反应 |
元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是
A元素原子的最外层电子数等于元素的最高化合价
B多电子原子中,在离核较近的区域内运动的电子能量较高
C P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强
D元素周期表中位于金属和非金属分界线附近的元素属于过渡元素