某化学研究性学习小组对硫酸铜分解气体产物的成分进行如下探究:
【查阅资料】
硫酸铜受热分解生成氧化铜和气体,温度不同时,气体可能为SO3,SO2和O2中的一种、两种或三种。
【提出假设】
假设1:气体产物只有一种;
假设2:气体产物只有两种;
假设3:气体产物有三种。
(1)若假设1成立,则产物气体的成分是 ;若假设2成立,则产物气体的成分是 。
【实验及结果讨论】
(2)甲同学将分解生成的气体依次通过盛浓硫酸和KMnO4酸性溶液的洗气瓶,能说明产物气体中含SO2的现象是 ,该现象说明SO2具有的性质是 ,实验中还发现盛浓硫酸的洗气瓶质量明显增加,原因是 。
(3)乙同学将分解生成的气体通过碱石灰后,再收集测定剩余气体的体积,在不同温度下进行3组实验。请完成下表(实验中硫酸铜均完全分解):
| 实验 序号 |
称取CuSO4 的质量/g |
碱石灰的 增加质量/g |
剩余气体的体积(折算 成标准状况下)/mL |
结论 |
| Ⅰ |
6.4 |
|
|
假设1成立 |
| Ⅱ |
6.4 |
2.88 |
224 |
|
| Ⅲ |
6.4 |
2.56 |
448 |
|
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下: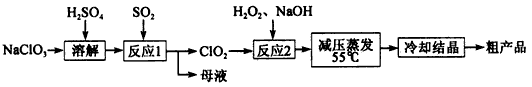
(1)提高“反应l”反应速率的措施有______________(写出一条即可)。
(2)“反应2”的氧化剂是________,该反应的化学方程式为__________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从 “母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经_____________(填操作名称)即可获得粗产品。
某研究小组用黄铜矿(主要成分是CuFeS2,其中S为-2价)为主要原料炼铜,其总反应为:2CuFeS2+2SiO2+5O2=2Cu+2FeSiO3+4SO2。事实上该反应是按如下流程分步进行的:

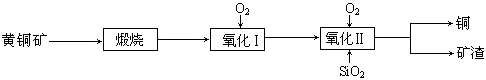
(1)氧化Ⅰ的反应主要是煅烧生成的硫化亚铁被进一步氧化为氧化亚铁,并与二氧化硅反应生成矿渣。矿渣的主要成分是(填化学式)。
(2)据报道,有一种细菌在氧气存在下可以将黄铜矿氧化成硫酸盐,反应是在酸性溶液中发生的。该反应的化学方程式为。
(3)我国学者研究发现,以精CuFeS2矿为原料在沸腾炉中与O2(空气)反应,生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O,生产成本能够降低许多。有关实验结果如下表:
| 沸腾炉温度/℃ |
560 |
580 |
600 |
620 |
640 |
660 |
| 水溶性Cu/% |
90.12 |
91.24 |
93.50 |
92.38 |
89.96 |
84.23 |
| 酸溶性Cu/% |
92.00 |
93.60 |
97.08 |
97.82 |
98.16 |
98.19 |
①CuFeS2与O2反应的化学方程式为。
②实际生产过程中沸腾炉温度为600~620 ℃。则控制温度的方法是。
③当温度高于600~620 ℃时,生成物中水溶性铜下降的原因是。
④生成物冷却后的除铁的实验操作方法主要是。已知在溶液中,Cu2+开始沉淀和沉淀完全的pH分别为4.7、6.7,Fe3+开始沉淀和沉淀完全的pH分别为1.1、3.2;如果制得的硫酸铜溶液中含有少量的Fe3+,请写出除去溶液中Fe3+的实验操作步骤:。
Na2S2O3(俗称保险粉)在医药、印染中应用广泛,可通过下列方法制备:取15.1 gNa2SO3溶于80.0 mL水。另取5.0 g硫粉,用少许乙醇润湿后加到上述溶液中。小火加热至微沸,反应1小时后过滤。滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O。
(1)加入的硫粉用乙醇润湿的目的是。
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机化合物杂质是;其检测的方法是:取出少许溶液,加盐酸至酸性后,过滤除去S,再加BaCl2溶液。则加入的盐酸发生两个反应的化学方程式为:
Na2SO3+2HCl=SO2↑+H2O+2NaCl;。
(3)某环境监测小组用含0.100 mol·L-1Na2S2O3溶液[含少量的Na2SO3,且n(Na2S2O3) ∶n(Na2SO3)
= 5∶1]测定某工厂废水中Ba2+的浓度。他们取废水50.0 mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀硫酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,用上述Na2S2O3溶液进行滴定,反应完全时,测得消耗Na2S2O3溶液的体积为36.0 mL。
(已知有关反应的离子方程式为:①Cr2O72-+6I-+14H+2Cr3++3I2+7H2O;
②I2+2S2O32-2I-+S4O62-;③I2+SO32-+H2O2I-+SO42-+2H+)
则滴定过程中可用作指示剂。计算该工厂废水中Ba2+的物质的量浓度。
硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式:。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是。
(3)滤渣c是。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为:
2NO+O2 =2NO2、。
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,写出硫酸铜受热分解的化学方程式:。
某同学设计了如下图所示的实验装置分别测定生成的SO2气体、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由:。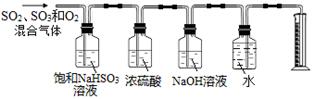
工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3做冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下图所示:
(已知:NaCl熔点为801℃;AlCl3在181℃升华)
(1)向滤液中通入过量CO2所发生反应的离子方程式为。
(2)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为。
(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有______。固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________。
(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为_____________。
(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是_____________。