Na2S2O3·5H2O 俗称“海波”,是常用的脱氧剂、定影剂和还原剂;它是无色易溶于水的晶体,不溶于乙醇,在20 ℃ 和70 ℃ 时的溶解度分别为60.0 g和212 g,Na2S2O3·5H2O于40~45 ℃熔化,48 ℃分解。下面是实验室制备及相关性质实验。
制备海波的反应原理:Na2SO3+S Na2S2O3
Na2S2O3
制备海波的流程:
(1)实验开始时用1 mL乙醇润湿硫粉的作用是 。
A.有利于亚硫酸钠与硫磺的充分接触
B.防止亚硫酸钠溶解
C.控制溶液的pH
D.提高产品的纯度
(2)趁热过滤的原因是 。
(3)滤液不采用直接蒸发结晶的可能原因是 。
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是 。
A.无水乙醇 B.饱和NaCl溶液 C.水 D.滤液
(5)产品的纯度测定:取所得产品10.0 g,配成500 mL溶液,再从中取出25 mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050 mol/L的标准碘水溶液滴定,重复三次,平均消耗20 mL标准碘水,涉及的滴定反应方程式为:I2+2Na2S2O3 2NaI+Na2S4O6。产品中的Na2S2O3·5H2O的纯度为 %。
2NaI+Na2S4O6。产品中的Na2S2O3·5H2O的纯度为 %。
已知丙酮与柠檬醛在一定条件下反应可以合成假紫罗兰酮,再进一步可以合成有工业价值的紫罗兰酮,如:
下图是合成有机物A的路线图,反应条件和一些不必列出的产物等均已删去。
(1)⑥中官能团的名称是。
(2)写出结构简式②⑤⑥。
(3)写出化学方程式①→②,反应类型;
⑤→⑥,反应类型。
(4)⑤的某种同分异构体符合下列条件,写出所有可能的结构简式。
a.无支链 b.能发生银镜反应 c.核磁共振氢谱有四组吸收峰
(1 5分)
原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼铁;Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能层为全充满状态,且核外的未成对电子只有一个。回答下列问题:
(1)X能形成多种常见单质,在熔点最低的单质中,每个分子周围紧邻的分子数为;在熔点最高的两种单质中,X的杂化方式分别为、。
(2)X、Y分别与H形成的化学键的极性关系为X—HY —H,键能关系为
—H,键能关系为
X—H__Y—H(填“<” 、“>”或“=”)。
、“>”或“=”)。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测Z元素的电离能突增应出现在第电离能。
(4)短周期元素中有一种元素与Z元素位于不同周期的相邻主族,且性质与Z十分相似,由该元素形成的单质属于 晶体。
晶体。
(5)W的价电子排布图为;W的基态原子有种形状不同的原子轨道,W基态原子有种形状不同的原子轨道;W单质中W原子的配位数为;下图表示的是W晶体中微粒的堆积方式(填甲、乙或丙);工业冶炼W的单质有两种常见方法,写出火法炼W的化学方程式。
(6)向W的硫酸盐溶液中逐滴滴加氨水至过量,最终形成的化合物中含、键(填化学键类型,任写两种即可)。
甲醇是一种非常好的燃料。熔点-97.8°C,沸点64.5°C。一定条件下,CO与H2反应可制得甲醇:CO+2H2 CH3OH
CH3OH
图1表示该反应进行过程中的能量变化;
图2表示100°C,在体积为2L的恒容容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。
(1)已知CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol,写出表示CH3OH燃烧热的热化学方程式。
(2)根据上图2计算:该温度下,反应CO(g)+2H(g) CH3OH(g)的平衡常数为10min后,容器内的压强变为原来的倍;改变下列条件,能提高CO转化率的是。
CH3OH(g)的平衡常数为10min后,容器内的压强变为原来的倍;改变下列条件,能提高CO转化率的是。
A.降低温度 B.加催化剂
C.充入氩气,使体系压强增大 D.再充入1molCO和2molH2
E.恒温恒容改为恒温恒压
(3)已知:CH3OH可以在一定条件下转化为HCOOH,HCOOH和CH3COOH性质相似。25°C,0.1mol/L的HCOOH溶液的pH>1。室温下,向0.1mol/L的HCOOH中加NaOH。
①当溶液中离子浓度关系满足c(HCOO-)<c(Na+)时,则反应的情况可能为;
A.NaOH不足,HCOOH剩余 B.HCOOH与NaOH恰好完全反应
C.NaOH过量
②若加入过量的NaOH,在加入NaOH的过程中,H2O的电离程度如何变?。
下图中A—J分别代表有关反应中的一种单质或化合物,其中B、C、D、I均为无色气体。(部分产物和反应条件已略去)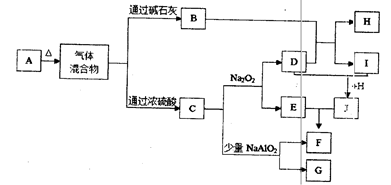
(1)若A加热后得到等物质的量的B和C,则A的化学式为。
(2)实验室检验B的方法是。
(3)写出上述由I生成J的化学方程式。
(4)写出C和少量NaAlO2溶液反应的离子方程式。
(5)由H所含的两种元素组成的18电子微粒的电子式为。
(6)若实验室要制备纯净的物质C(可含水蒸气)所需试剂最好选择(填代号);
A.石灰石B.稀HNO3C.稀H2SO4D.稀HCl E.纯碱
所需气体发生装置是(填代号);所选装置中涉及到的玻璃仪器的名称为。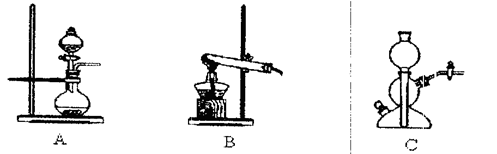
(1.5分)
某地有软锰矿和闪锌矿两座矿山,它们的组成如下:
软锰矿:MnO2含量≥65%,SiO2含量约20%,A12O3含量约4%,其余为水分;
闪锌矿:ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分。
科研人员开发了综合利用这两种资源的同 槽酸浸工艺,工艺流程如下图所示。
槽酸浸工艺,工艺流程如下图所示。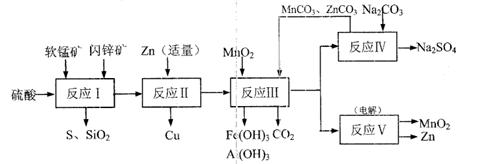
请回答下列问题:
(1)反应I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al:(SO4)3等。试完成反应I中生成CuSO4和MnSO4的化学方程式:
MnO2+CuS+ = ↓+ +CuSO4+
(2)反应Ⅱ加入适量锌的作用是 ;如果锌过量,还会进一步发生反应的离子方程式为 。
(3)反应III要调节pH生成Fe (OH)3、Al(OH)3,中和过量的H+所使用的物质是 ,调节的pH范围是 (pH数据见右表)。
| 沉淀物 |
Fe(OH)3 |
A1(OH)3 |
Zn(OH)2 |
| 开始沉淀pH |
2.3 |
4.0 |
5.4 |
| 完全沉淀pH |
4.1 |
5.2 |
8.0 |
(4)本工艺可以循环利用的物质除有MnCO3、ZnCO3以外,还有 。