三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H 2O 2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:
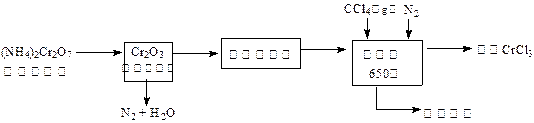
(1)重铬酸铵分解产生的三氧化二铬(Cr 2O 3难溶于水)需用蒸馏水洗涤的原因 ▲ ,如何用简单方法判断其已洗涤干净 ▲ 。
(2)已知CCl 4沸点为57.6℃,为保证稳定的CCl 4气流,适宜的加热方式是 ▲ 。
(3)用右图装置制备CrCl 3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通人氮气,使CCl 4蒸气经氮气载入反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl 4,并加热CCl 4,温度控制在50~60℃之间;④反应管出口端出现了CrCl 3升华物时,切断加热管式炉的电源;⑤停止加热CCl 4,继续通人氮气;⑥检查装置气密性。正确的顺序为:⑥→③→
▲ 。
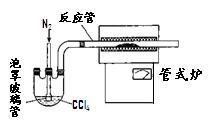
(4)已知反应管中发生的主要反应有:Cr 2O 3+ 3CCl 4→ 2CrCl 3+ 3COCl 2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl 2,生成一种含氧酸酯(C 5H 10O 3),用乙醇处理尾气的化学方程式为 ▲。
(5)样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa 2O 2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH 2SO 4至溶液呈强酸性,此时铬以Cr 2O 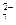 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr 2O 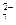 +6I -+14H +=2Cr 3++3I 2+7H 2O,2Na 2S 2O 3+I 2===Na 2S 4O 6+2NaI。
+6I -+14H +=2Cr 3++3I 2+7H 2O,2Na 2S 2O 3+I 2===Na 2S 4O 6+2NaI。
①该实验可选用的指示剂名称为 ▲ 。
②移入碘量瓶的CrCl 3溶液需加热煮沸,加入Na 2O 2后也要加热煮沸,其主要原因是 ▲ 。
③样品中无水三氯化铬的质量分数为 ▲ 。
[化学 ― 选修 3 :物质结构与性质] 化学中的某些元素与生命活动密不可分。请回答下列问题:
(1)(NH4)2SO4是一种重要的化学肥料,其中N、S原子的杂化方式分别是、,SO2-4的空间构型为。
(2)钙是儿童生长不可缺少的元素,基态钙原子中,电子没有全充满的能层是。
(3)蛋白质中含有N、P等元素,它们分别形成的简单气态氢化物键角大小关系是(用化学式表示),原因是。
(4)金属铁、镍及其形成的许多化合物常用作催化剂。已知NiO、FeO的晶体类型均与氯化钠晶体相同,熔点NiO>FeO,推测 Ni2+和 Fe2+离子半径的大小关系是,作出判断的依据是。
(5)某金属是抗癌药物中的明星元素,其晶体中原子的堆积方式如图所示。
晶胞中金属原子的配位数为。若已知金属的摩尔质量为M g/mol ,阿伏加德罗常数为NA,原子半径为r pm,则该晶胞的密度为 p=g/ cm3。(用含M、NA、r的计算式表示,不用化简)
[化学 ― 选修 2 :化学与技术]一种将废水(含Ca2+、Mg2+、CN-及悬浮物)通过净化、杀菌消毒生产自来水的流程示意图如下: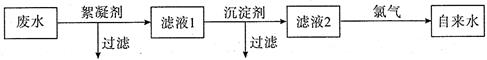
(1)絮凝剂除去悬浮物质时发生物理变化和化学变化,下列既发生物理变化又发生化学变化的是(填标号)。
A.蒸馏B.煤干馏C.风化D.分馏
(2)绿矾是常用的絮凝剂,它在水中最终生成(填化学式)沉淀,下列物质中也可以作为絮凝剂的有(填标号)。
A.NH4ClB.食盐C.明矾D.CH3COONa
若用FeCl3作絮凝剂,实践中发现废水中的c(HCO-3)越大,净水效果越好,原因是。
(3)加沉淀剂是为了除去Ca2+、Mg2+,若加入生石灰和纯碱作沉淀剂,试剂添加时先加后加,理由是。此时Ca2+、Mg2+离子分别形成、(填化学式)而沉淀下来。
(4)向滤液2中通人Cl2的作用有两种:一是利用生成的(填名称)具有强氧化性能杀死水中的病菌;二是将CN-氧化成CO2和N2,从而消除CN-的毒性,若参加反应的C12与CN-的物质的量之比为5: 2,则该反应的离子方程式是。
[化学一选修3:物质结构与性质](15分)
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。回答下列问题:
(1)基态砷原子的电子排布式为。
(2)K3[Fe(CN)6]晶体中Fe3+与CN一之间化学键类型为键,与CN一互为等电子体的化合物分子式为。
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有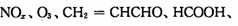
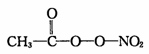 (PAN)等二次污染物。
(PAN)等二次污染物。
N2O结构式可表示为N=N=O,N2O中中心氮原子的杂化轨道类型为,1 mol PAN中含σ键数目为。
测定大气中PM2.5的浓度方法之一是 一射线吸收法,
一射线吸收法,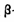 一射线放射源可用85 Kr。Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则
一射线放射源可用85 Kr。Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则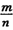 =(填数字)。已知Kr晶体的密度为
=(填数字)。已知Kr晶体的密度为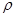 g/cm3 ,摩尔质量为Mg/ mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a=nm
g/cm3 ,摩尔质量为Mg/ mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a=nm
(15分)元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等。这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用。请回答下列问题:
(1)N4分子是一种不稳定的多氮分子,这种物质分解后能产生无毒的氮气并释放出大量能量,能被应用于制造推进剂或炸药。N4是由四个氮原子组成的氮单质,其中氮原子采用的轨道杂化方式为sp3,该分子的空间构型为________,N—N键的键角为________。
(2)基态砷原子的最外层电子排布式为________。
(3)N、P、As原子的第一电离能由大到小的顺序为____________(用元素符号表示)。
(4)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N3-互为等电子体的分子的化学式________(任写一种即可)。
(5)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸[HOCH2CH(NH2)COOH]。判断丝氨酸是否存在手性异构体?________(填“是”或“否”)
(6)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm,则密度为_______g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为________pm(用含c的式子表示)。
现代传感信息技术在化学实验中有广泛的应用。
Ⅰ.某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1)。
(1)制取氨气。烧瓶中制取NH3的化学方程式为 ,检验三颈瓶集满NH3的方法是 。
(2)关闭a,将吸有2mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2)。图2中 点时喷泉最剧烈。
Ⅱ.测定NH3•H2O的浓度及电离平衡常数Kb
(3)从三颈瓶中用 (填仪器名称)量取25.00mL氨水至锥形瓶中,用0.0500 mol•L-1HCl滴定。用pH计采集数据、电脑绘制滴定曲线如下图。
(4)据图,计算氨水的浓度为 mol•L-1;写出NH3•H2O电离平衡常数Kb的表达式,Kb= ,当pH=11.0时计算Kb的近似值,Kb≈ 。
(5)关于该滴定实验的说法中,正确的是 。
| A.锥形瓶中有少量蒸馏水不影响测定结果 |
| B.未滴加酸碱指示剂,实验结果不科学 |
| C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高 |
| D.滴定终点时俯视读数会导致测得氨水的浓度偏高 |