某学生在如图5-8所示装置中用苯和液溴制取溴苯,请根据下列实验步骤完成有关问题:
图5-8
(1)第一步,在分液漏斗中依次加入10 mL苯和5 mL液溴,使之混合均匀,此时观察到溴溶于苯,不反应,溶液呈深棕红色。
第二步,打开分液漏斗活塞,将苯、溴混合液按一定速度,逐滴加入玻璃管甲中的铁丝上,观察到的现象是__________________________________________________。
从上述两步观察到的现象差异,可得出的结论是______________________________。
(2)第三步,几分钟后,打开胶皮管夹A和B,使反应混合液流入U形管中,打开管夹B的原因是______________________________________________________;然后通过分液漏斗向U形管中加入适量的NaOH溶液,目的是__________。
(3)第四步,关闭胶皮管A和B,连同A和B一起取下U形管,用力振荡并静置后,观察到溴苯的颜色是__________,它在U形管中液体的__________层(填“上”或“下”)。此步关闭管夹A和B的目的是_______________________________________________________________。
(4)要证明上述溴跟苯的反应是取代反应而不是加成反应,请根据装置乙的作用完成下列各题:
①小试管内的液体是__________ (填名称),作用是____________________。
②锥形瓶内的液体是__________ (填名称),作用是____________________。
③反应后,向锥形瓶内滴加试剂__________ (填名称)溶液,作用是__________。此外,装置乙还能起到__________的作用。
(5)写出上述苯跟溴反应的化学方程式___________________________________________。
(1)硫酸的摩尔质量是 ,24.5g硫酸中所含的氧原子数目为 ,48g的氧气在标准状况下的体积是 。
(2)0.2 mol Al2(SO4)3中含有n(Al3+)_______mol,m(SO42-)_________g。某硫酸钠溶液中含有3.01×1022个Na+,则该溶液中SO42-的物质的量是n(SO42-)______ mol,该溶液中Na2SO4的质量为___________克。
(3)同温同压下的N2和H2,若体积相同时,两种气体的质量比为 ,其密度比为 ;若质量相等时,两种气体的体积比 。
物质A是生产各种塑料的重要单体,工业上采用物质B分解制备物质A的同时释放出氢气,其制备原理是:B(g) A(g)+H2(g)ΔH=+125kJ·mol—1
A(g)+H2(g)ΔH=+125kJ·mol—1
(1)该反应的平衡常数表达式为K="______________。随着温度的升高,K" 值____________ (填“增大”、“减小”或“不变”)。
(2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。物质B的平衡转化率与水蒸气的用量、体系总压强关系如下图。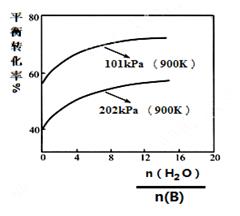
①由上图可得出:
结论一:
其他条件不变,水蒸气的用量越大,平衡转化率越___;
结论二 :______________________________________
②加人稀释剂能影响反应物B的平衡转化率的原因是:__________________。
(3)某些工艺中,在反应的中途加入O2和特定的催化剂,有利于提高B的平衡转化率。试解释其原因:________________________。
固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1
某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
(1)a点正反应速率___________(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是__________,最小的是______。
| A.0~1min | B.1~3min |
| C.3~8min | D.8~11min |
(3)求平衡时氢气的转化率和该条件下反应的平衡常数K。(写出计算过程)
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线II对应的实验条件改变是___________。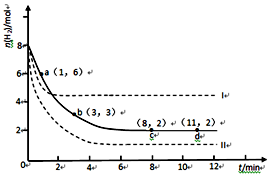
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
C+ K2Cr2O7+ H2SO4 ═ CO2↑+ K2SO4+ Cr2(SO4)3+ H2O
请完成并配平上述化学方程式.其中氧化剂是 ,氧化产物是
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)⇌CH3OH(g) △H1=﹣116kJ•mol﹣1
①已知:2CO(g)+O2(g)=2CO2(g)△H2=﹣566kJ•mol﹣1
2H2(g)+O2(g)=2H2O(g) △H3=﹣484kJ•mol﹣1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为 ;
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答: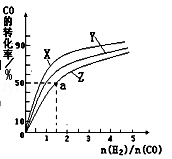
A)在上述三种温度中,曲线Z对应的温度是
B)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)⇌CH3OH(g)的平衡常数K= .(写明单位)
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L﹣1)变化如下表所示:
| 0min |
5min |
10min |
|
| CO |
0.1 |
0.05 |
|
| H2 |
0.2 |
0.2 |
|
| CH3OH |
0 |
0.04 |
0.05 |
若5min~10min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是 .
Cu2S是一种灰黑色硫化物,不溶于水,能溶于硝酸。当溶于过量的一定浓度的硝酸时,生成Cu(NO3)2与CuSO4的混合溶液、NO气体和另一产物。
(1)写出该条件下反应的化学方程式: 。
(2)当有0.7 mol的SO42-生成时,该反应中转移的电子数为 。
(3)该反应中的氧化产物为 ,硝酸在该反应中体现了 (选填“氧化性”、“还原性”、“酸性”)。