25℃时,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合(混合后溶液体积为混合前两溶液的体积之和)。下列叙述错误的是
| A.混合溶液可能显示酸性、碱性或中性 |
| B.混合溶液中一定存在c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| C.若a>b,则混合溶液中c(C1-)=c(NH4+)+c(NH3·H2O) |
D.若混合溶液显中性;则NH3·H2O的电离平衡常数为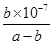 mol·L-1 mol·L-1 |
甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是()
A.CH3Cl不存在同分异构体 |
B.CHCl3不存在同分异构体 |
| C.CH2Cl2不存在同分异构体 | D.CH4中的四个键相同 |
烃是()
A、含有C、H元素的有机物 B、含 有C元素的化合物
有C元素的化合物
C、仅由C、H两种元素组成的有机物 D、完全燃烧只生成CO2和H2O的化合物
在理论上不能用于设计原电池的化学反应是()
| A.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) |
| B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) |
C.2FeCl2+Cl2=2FeCl 3 3 |
| D.3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O |
有一瓶无色气体,可能含有CO2、H2S、HCI、HBr、SO2中的一种或几种。将足量氯水倒入瓶里,振荡,静置得无色透明溶液。将该溶液分为两份:向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份加入稀硝酸酸化的AgNO3溶液,也产生了白色沉淀,.由此可知,正确的结论是
C、肯定没有CO2、H2S、HBr D、以上结论均不正确
用铝热法还原下列物质,制得金属各1mol,消耗铝最少的是
| A.Fe3O4 | B.MnO2 | C.Cr2O3 | D.V2O5 |