在一定温度下,向2L体积固定的密闭容器中加入1molHI,2HI(g) H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确的是
H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确的是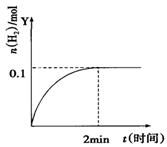
| A.该温度下,反应的平衡常数是1/8 |
| B.0~2min内的HI的平均反应速率为0.05mol•L-1•min-1 |
| C.恒压下向该体系中加入N2,平衡不移动,反应速率不变 |
| D.升高温度,平衡向正反应方向移动,只有正反应速率加快 |
下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是()
| A.④>②>①>③ | B.②>①>③>④ |
| C.④>②>③>① | D.③>②>④>① |
下图所示,用石墨作电极进行电解,电解槽甲中盛AgNO3溶液,电解槽乙中盛有含二价金属G的氯化物溶液1 L,其物质的量浓度为0.1 mol·L-1,当通电一段时间后,电解槽甲中阴极增重0.27 g,乙中阴极增重0.14 g,则元素G的相对原子质量为( )
| A.112 | B.73 | C.64 | D.65 |
200 mL 2 mol·L-1的NaCl溶液(ρ="1.10" g·mL-1)在铜电极的电解池中不断搅拌下进行电解。当在阴极上有22.4 L的气体放出时停止电解。电解后溶液中NaCl的质量分数为( )
| A.12.72% | B.7.96% | C.8.30% | D.无法计算 |
若在铁片上镀锌,以下叙述错误的是( )
| A.把铁片与电源的正极相连 |
| B.电解质必须用含有锌离子的可溶性盐 |
| C.锌极发生氧化反应 |
D.铁极的电极反应式为Zn2++2e- Zn Zn |
用石墨作电极电解AlCl3溶液时,下图所示电解质溶液变化的曲线合理的是(不考虑Cl2溶解)( )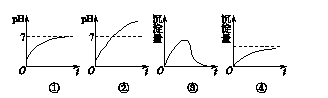
| A.①③ | B.①④ | C.②③ | D.②④ |