下列各组热化学方程式中,Q1<Q2的是( )
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-Q1 kJ·mol-1 CH4(g)+3/2O2(g)=CO(g)+2H2O(g) ΔH=-Q2 kJ·mol-1 |
| B.S(g)+O2(g)=SO2(g) ΔH=-Q1 kJ·mol-1 S(s)+O2(g)=SO2(g) ΔH=-Q2 kJ·mol-1 |
| C.H2(g)+Br2(g)=2HBr(g) ΔH=-Q1 kJ·mol-1 H2(g)+Cl2(g)=2HCl(g) ΔH=-Q2 kJ·mol-1 |
| D.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-Q1 kJ·mol-1 |
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-Q2 kJ·mol-1
下列叙述与胶体的性质无关的是()
| A.同一支钢笔使用不同品牌墨水时,容易发生堵塞现象 |
| B.当日光从窗隙射入暗室时,可观察到一束光线 |
| C.向氢氧化铁与水形成的某分散系中插入正、负电极,通直流电一段时间后,一极附近颜色变深 |
| D.向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 |
一化学兴趣小组在家中进行化学实验,按照左图连接好线路发现灯泡不亮,按照右图连接好线路发现灯泡亮,由此得出的结论正确的是()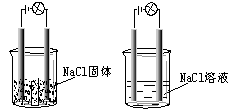
| A.NaCl固体中没有离子 |
| B.NaCl溶液是电解质 |
| C.NaCl溶液在电流作用下电离出大量的离子 |
| D.NaCl在水溶液中电离出了可以自由移动的离子 |
下列叙述正确的是()
| A.0.012 kg12C含有6.02×1023个碳原子 | B.1mol任何物质都含有6.02×1023个原子 |
| C.硫酸的摩尔质量是98g | D.常温常压下,1 mol氧气的体积为22.4L |
下列物质中,属于电解质的是()
| A.铜丝 | B.MgCl2 固体 | C.NaCl溶液 | D.酒精(C2H5OH) |
Fe(OH)3胶体与MgCl2溶液共同的性质是()
| A.都不稳定,温度不变,密闭放置一段时间都可产生沉淀 |
| B.两者都有“丁达尔效应” |
| C.两者都能透过滤纸 |
| D.都很稳定,其中Fe(OH)3胶体比MgCl2溶液更稳定 |