(1)生产水煤气过程中有以下反应:①C(s)+CO2(g)2CO(g) ΔH1;
②CO(g)+H2O(g)  H2(g)+CO2(g) ΔH2;
H2(g)+CO2(g) ΔH2;
③C(s)+H2O(g)  CO(g)+H2(g) ΔH3;
CO(g)+H2(g) ΔH3;
上述反应ΔH3与ΔH1、ΔH2之间的关系为__________________________________。
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为
2CH4(g)+3O2(g)  2CO(g)+4H2O(g)
2CO(g)+4H2O(g)
ΔH=-1 038 kJ·mol-1。
工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
①X在750 ℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600 ℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440 ℃时催化效率最高,能使逆反应速率加快约1×106倍;
根据上述信息,你认为在生产中应该选择的适宜催化剂是________(填“X”或“Y”或“Z”),选择的理由是________________________________________________________;
(3)请画出(2)中反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
A、B、C、D、E五种微粒,它们可能是原子或离子,并且所含的元素都在短周期。A显负价时,不能被任何氧化剂氧化;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3;D的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有10个电子,E极易与C+结合成中性微粒。回答:
(1)写出五种微粒的符号:A、B、C、D、E。
(2)C的同位素名称:C2。
(3)C和D形成分子的电子式为,空间结构为。
(8分)氨的合成是最重要的化工生产之一。
(1)工业上可用甲烷与水反应得到合成氨用的H2:其热化学反应方程式为CH4(g)+H2O(g)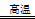 CO(g)+3H2(g) △H4,已知有关反应的能量变化如下图所示:
CO(g)+3H2(g) △H4,已知有关反应的能量变化如下图所示: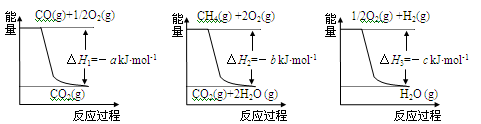
则△H4=______________(用a、b、c表示)
(2)在2个恒压的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g) 2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
| 达到平衡的时间(min) |
t |
5 |
| 平衡时N2的浓度(mol·L-1) |
3 |
c |
①甲容器达到平衡所需要的时间t5min(填“>”、“<” 或“=”,下同);乙容器达到平衡时N2的浓度c3 mol·L-1。
②下图中虚线为该反应在使用催化剂条件下,关于起始N2与H2投料比和 H2平衡转化率的关系图。当其他条件完全相同时,用实线画出不使用催化剂情况下H2平衡转化率的示意图。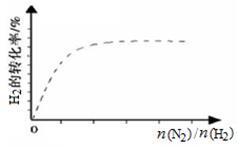
(8分)碳的化合物与人类生产、生活密切相关。
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,发生以下反应:CO(g)+H2O(g)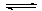 CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO(g)和H2O(g),t℃时测得部分数据如下表。
| T/min |
0 |
1 |
2 |
3 |
4 |
| n(H2O)/mol |
1 |
0.8 |
0.65 |
0.6 |
0.6 |
| n(CO)/mol |
0.8 |
0.6 |
0.45 |
0.4 |
0.4 |
则该温度下反应的平衡常数K=________。
(2)相同温度下,若向该容器中充入l molCO、x molH2O(g)、y molCO2、2 molH2,此时v(正)=v(逆),则x、y的关系式是________________。
II.在一恒温、恒容密闭容器中发生反应:
Ni(s)+4CO(g) Ni(CO)4(g),△H,则△H_____0,(填“>”、“<”);缩小容器容积,平衡向_______(填“左”或“右”)移动,△H_______(填“增大”、“减少”或“不变”,下同),混合气体的密度_________。
Ni(CO)4(g),△H,则△H_____0,(填“>”、“<”);缩小容器容积,平衡向_______(填“左”或“右”)移动,△H_______(填“增大”、“减少”或“不变”,下同),混合气体的密度_________。
(8分)已知下表为25℃时某些弱酸的电离平衡常数;下图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化。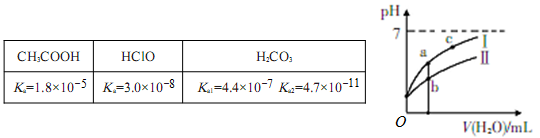
(1)图像中,曲线Ⅰ表示的酸是_____(填化学式);起始时,c(CH3COOH)_______c(HClO)(填“>”、“<”、“=”)。
(2)a、b、c三点中,水的电离程度由大到小的顺序是___________(用编号表示)。
(3)25℃时,NaClO溶液的水解平衡常数Kh=_______________。
(4)向NaClO溶液中通入少量CO2的离子方程式为____________________。
(9分)将反应IO3-+5I-+6H+ 3I2+3H2O设计成如图所示的原电池。
3I2+3H2O设计成如图所示的原电池。
(1)开始时向甲烧杯中加入少量浓硫酸,电流计指针向右偏转,此时甲池中发生的电极反应式为____________,工作过程中关于电流计的读数,下列说法正确的是_______(填编号)
a.电流计读数逐渐减小b.电流计读数有可能变为0
c.电流计读数一直不变d.电流计的读数逐渐增大
(2)如果在加浓硫酸前,甲、乙烧杯中都加入淀粉溶液,则溶液变蓝的烧杯是_______(填“甲”、“乙”)。
(3)工作一段时间后,如果再向甲烧杯滴入浓NaOH溶液,此时乙池中发生的电极反应式为____________,电流计指针向_____(填“左”、“右”)偏转。