已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)  Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=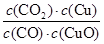 |
| B.反应③的平衡常数K=K1/K2 |
| C.对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值 |
| D.对于反应③,恒温恒容时,若增大压强,H2的浓度一定减小 |
上海作为2010年世博会的举办城市,公共交通的“绿色”也已经在进行,以二甲醚(化学式为C2H6O,简称甲醚)为燃料的公共交通作为“绿色”花园中的一点鲜艳的绿色已正式启动,解决了汽车尾部冒黑烟的问题。下列叙述正确的是
| A.甲醚与乙醇是同分异构体 |
| B.甲醚可由甲醇在一定条件下发生消去反应而制得 |
| C.甲醚作燃料不会产生氮的氧化物和碳氢化合物的污染 |
| D.1mol甲醚完全燃烧消耗的氧气与1mol甲醇完全燃烧消耗的氧气相同 |
甲、乙、丙、丁四种易溶于水的物质,分别由Na+、Ba2+、Al3+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成,
已知:①0.1 mol·L-1甲溶液中c(H+)>0.1 mol·L-1;
②将少量乙溶液分别滴入其他三种物质的溶液时,均有白色沉淀生成;
③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列判断正确的是
| A.甲溶液含有SO42- | B.乙溶液含有SO42- |
| C.丙溶液显酸性 | D.丁溶液显酸性 |
磷酸燃料电池是目前较为成熟的燃料电池,其基本组成和反应原理如下: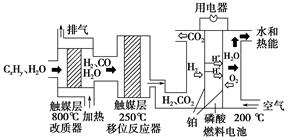
下列说法不正确的是
A.在改质器中主要发生的反应为CxHy+xH2O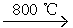 xCO+(x+ xCO+(x+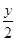 )H2 )H2 |
B.移位反应器中发生的反应为:CO(g)+H2O(g) CO2(g)+H2(g) ΔH>0,温度越高,CO转化速率越大 CO2(g)+H2(g) ΔH>0,温度越高,CO转化速率越大 |
| C.负极排出的气体主要是CO2 |
| D.该电池正极的电极反应为O2+4H++4e-=2H2O |
下列根据实验操作和现象所得出的结论正确的是:
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向溶液中滴加盐酸酸化的BaCl2溶液 |
产生白色沉淀 |
溶液中一定含有SO42- |
| B |
向溶液X中先滴加稀NaOH溶液,再将湿润红色石蕊试纸置于试管口附近 |
试纸不变蓝 |
原溶液中无NH4+ |
| C |
向PbO2中滴入浓盐酸 |
有黄绿色气体 |
PbO2具有氧化性 |
| D |
向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 |
有白色沉淀生成 |
溶液X中一定含有CO32- |
反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2;②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2。已知NaIO3的氧化性与MnO2相近,下列有关说法正确的是
| A.I2在反应①中是氧化产物,在反应②中是还原产物 |
| B.两个反应中生成等量的I2时转移的电子数相等 |
| C.NaI和NaIO3在一定条件下能反应生成I2 |
| D.NaIO3在化学反应中只能作氧化剂,不能作还原剂 |