氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:

提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是__________,发生反应的离子方程式为__________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________________。
(2)反应③的反应类型为____________,过滤得到的滤渣中,除了过量的锌外还有______________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是________________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2,取干燥后的滤饼11.2 g,煅烧后可得到产品8.1 g,则x等于__________。
(1)下列说法不正确的是。
A.由于铜盐能杀死某些细菌,并能抑制藻类生长,因此游泳池馆常用硫酸铜作池水消毒剂
B.明矾溶于水后能生成Al(OH)3胶体,它能凝聚水中的悬浮物并起到杀菌消毒的作用,从而达到净水的目的
C.铝制品表面有致密的氧化膜保护层,所以不能盛放酸、碱溶液,但可以长时间盛放咸菜等腌制品
D.工业电解氧化铝时,向其中添加冰晶石,使氧化铝的熔点降低,从而减少冶炼过程中的能量消耗
(2)下列有关说法正确的是。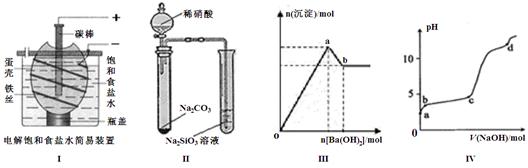
A.按图I装置电解一段时间后,往蛋壳外溶液中滴加几滴酚酞,溶液呈红色
B.按图II装置实验,可以证明酸性强弱关系为:硝酸>碳酸>硅酸
C.图III表示:向明矾溶液中逐滴加入Ba(OH)2溶液,生成沉淀的物质的量随Ba(OH)2加入量的变化曲线,则oa段发生的离子反应为:2Al3+ + 3SO42- + 3Ba2+ + 6OH- = 2Al(OH)3 ↓+ 3BaSO4↓
D.图IV表示:室温时,将1 mol·L–1 NaOH溶液逐滴滴入0.2 mol·L–1 Al2(SO4)3溶液中,实验测得溶液pH随NaOH溶液体积变化曲线,则d点时Al(OH)3沉淀开始溶解
(3)常温常压下,将一定质量的Fe、Fe2O3、Fe3O4的混合物平均分成两份:一份溶于一定量的稀硝酸中恰好完全反应,生成0.1 mol NO气体;另一份溶于足量稀盐酸中生成一定量气体。向两次反应后溶液中分别加入硫氰化钾溶液,溶液颜色均无明显变化,则固体溶于盐酸后生成的气体,在标准状况下的体积约为mL。
某pH=1的溶液X,其中可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42ˉ、SiO32ˉ、NO3ˉ中的一种或几种离子,取200mL溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。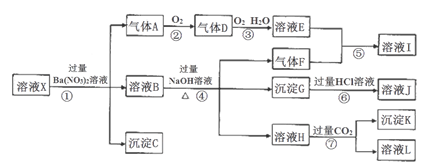
请回答下列问题:
(1)仅由强酸性条件便可判断溶液X中一定不存在的离子有___________;
(2)溶液X中,关于NO3ˉ的判断一定正确的是______;
a.一定有b.一定没有c.可能有
(3)①中产生气体A的离子方程式为_________________;
(4)⑦中生成沉淀K的离子方程式为_______________;
(5)溶液X中不能确定的离子是________,若要用实验证明该离子一定不存在,其中最可靠的化学方法为_______________________;
(6)若实验测定A、F、K均为0.01mol,试确定沉淀C及其物质的量:_______________。
磷的单质和化合物是重要的化工产品。查阅资料可知:亚磷酸(H3PO3)、次磷酸(H3PO2)以及它们的盐都有较强还原性,可用于化学镀银或镀镍;亚磷酸是中强酸,它与足量的NaOH溶液反应生成Na2HPO3。试回答下列问题:
(1)Na2HPO3中P元素的化合价为_____________________;
(2)Na2HPO3是_______________(填“正盐”或者“酸式盐”),其溶液的pH________7 (填“>”、“=”或“<”)。
(3)利用次磷酸与硝酸银溶液反应进行化学镀银,反应中氧化剂与还原剂的物质的量之比为4︰1,该反应的化学方程式为:__________________。
(4)次磷酸钠(NaH2PO2)可用于化学镀镍。镀镍溶液中含Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)____Ni2+ +____H2PO2-+_____==____Ni+ + ______H2PO3-+ _______
(b)6H2PO2-+2H+ =2P+4H2PO3-+3H2↑
①请配平反应式(a);
②依据反应式(b),反应消耗掉6 mol H2PO2-时转移电子的物质的量为____________。
碱金属元素的单质和化合物在日常生活和化工生产中应用广泛。
(1)钠的原子结构示意图为______________________。
(2)过氧化钠可作为呼吸面具和潜水艇中的供氧剂。写出过氧化钠与二氧化碳反应的化学方程式:___。
(3)氯碱工业是利用电解饱和食盐水获取一系列化工产品的过程。若利用电解饱和食盐水所得的气体制100t 36.5%的浓盐酸,理论上至少需要消耗NaCl_________________ t。
(4)某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
①分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A的名称为_______。
②称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL 蒸馏水,振荡,发现Na2CO3固体完全溶解,而NaHCO3固体还有剩余,由此可以得出结论:___________。向所得溶液中滴入酚酞后,观察到的现象是________________。
③某同学为探究Na2CO3和NaHCO3与CaCl2溶液的反应,将两种固体分别配制成0.5 mol/L的溶液,设计如下方案并对反应现象做出预测:
| 实验方案 |
预测现象 |
预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1 mL 0.5 mol/L CaCl2溶液 |
有白色沉淀 |
Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2+ + CO32-=" " CaCO3↓。 |
| 操作2:向2mL NaHCO3溶液中滴加1 mL 0.5 mol/L CaCl2溶液 |
无白色沉淀 |
NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为:___________________________。
亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程: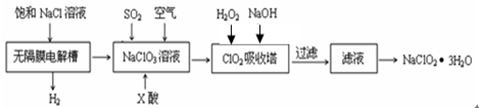
(1)反应生成ClO2气体需要X酸酸化,X酸可以为。
| A.盐酸 | B.稀硫酸 | C.硝酸 | D.H2C2O4溶液 |
(2)吸收塔内的温度不能过高的原因为。
(3)ClO2被S2-还原为ClO2-、Cl-转化率与pH关系如图。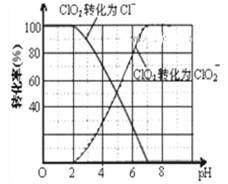
写出pH≤2时ClO2与S2-反应的离子方程式_______。
(4)ClO2对污水中CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,生成了两种无毒无害的气体,其离子反应方程式___________________________;处理100 m3这种污水,至少需要ClO2 _____________ mol。