用18mol/L的硫酸配制100 mL 1.0 mol/L的硫酸,若实验仪器有:A、100mL量筒;B、托盘天平;C、玻璃棒;D、50 mL容量瓶;E、10 mL量筒;F、胶头滴管;G、50 mL烧杯;H、100 mL容量瓶。
(1)实验时选用的仪器是________;(填仪器序号)
(2)在容量瓶的使用方法中,下列操作不正确的是( )
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心的倒入容量瓶中,加入蒸馏水到接近刻度线2—3cm处,再用滴管滴加蒸馏水到刻度线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线2—3cm处,再用滴管滴加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动几次
金属钛被称为铁和铝之后崛起的第三金属,它是空间技术、航海、化工、医疗上不可缺少的材料。
I、工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:_________(填“需要”或“不需要”)
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的离子方程式。
II、为了提高资源的利用率,减少环境污染,可将氯碱厂、炼钛厂和甲醇厂组成产业链,其关系如下图所示。
(3)写出钛铁矿经氯化法得到四氯化钛的化学方程式_________________________。
(4)已知:①Mg(s)+Cl2(g)=MgCl2(s);△H=一641 kJ·mol-1
②1/2Ti(s)+Cl2(g)=1/2TiCl4(l);△H=一385 kJ·mol-1
则Mg 与TiCl4反应的热化学方程式为,
该反应在氩气氛中进行的理由是。
(5)在上述产业链中,合成192 t 甲醇理论上需额外补充H2t (不考虑生产过程中物质的任何损失)。
用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是445.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s) + H2SO4(98%)==Na2SO4 + H2O + SO2↑
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合装置并将其序号填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是_______________、_______________、_______________。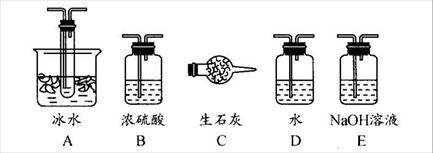
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是。
(3)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
(4)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为 %(用含a、b的代数式填写)
(5)尾端球形干燥管的作用是。
可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
图1 (图中表示生成1mol物质时的能量)图2
(1)根据图1请写出合成氨的热化学方程式 (热量用E1、E2或E3表示)
(2) 图1中虚线部分是通过改变化学反应中的 条件,请解释原因
。
(3)当反应达到平衡位置时不断改变条件(不改变N2、H2和NH3的量),图2表示反应速率与反应过程的关系,其中表示平衡混合物中NH3的含量最高的一段时间是
(4)在一定温度下,若将4a mol H2和2amol N2放入2L的密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是 (“正向移动”“ 逆向移动”或“不移动”)
(5)将上述实验中产生的NH3通入到0.04mol·L-1的FeCl3溶液中,要使溶液中Fe3+沉淀 较
完全(即Fe3+浓度降至原来的千分之一),则溶液的pH为 (已知常温下,Fe(OH)3的
溶度积常数Ksp=4×10-38)
粉煤灰是燃煤电厂排出的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为43.4%,还有含量较多的SiO2(其他成分不含Al和Si)。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式为:
Al6Si2O13+ 3Na2CO3→ 2NaAlSiO4+ 4NaAlO2 + 3CO2↑ ①
Al6Si2O13 + 5Na2CO3→ 2Na2SiO3 + 6NaAlO2 + 5CO2↑②
SiO2 + Na2CO3→ Na2SiO3 + CO2↑③
(1)粉煤灰中铝的质量分数为% 。
(2)用1 mol Al6Si2O13 和 4 mol SiO2制得5mol NaAlO2、1mol NaAlSiO4,还应制得Na2SiO3____________mol,共消耗Na2CO3mol(得到的固体中无SiO2)。
(3)若粉煤灰中 Al6Si2O13 与 SiO2的物质的量之比为1:2,则1kg粉煤灰与6mol Na2CO3反应(反应物全部都参与反应),可制得NaAlO2_________________mol。
(4)若用100 mol Al6Si2O13同时生产NaAlSiO4和NaAlO2,且n(NaAlSiO4):n(NaAlO2) = x,消耗Na2CO3y mol,试确定y与x的关系式。
用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路是成熟的传统工艺,现对某印刷电路生产厂家蚀刻绝缘板后所得的混合溶液(标记为A)进行如下分析:
①取50.0mL A溶液加入足量的硝酸银溶液,析出沉淀86.1g
②取50.0mL A溶液试探性地加入1.12g铁粉,结果全部溶解未见固体析出
③向实验②所得溶液中加入50 mL稀硝酸,产生1.12L NO(标准状况),反应后所得溶液的pH为1。
结合上述信息计算:
(1)所得沉淀的物质的量_____________mol;
(2)该厂所使用的FeCl3溶液的物质的量浓度_____________mol/L;
(3)A溶液中Cu2+的物质的量浓度。