钢铁工业是国家工业的基础,钢铁生锈现象却随处可见,为此每年国家损失大 量 资金.请回答钢铁腐蚀与防护过程中的有关问题.
(1)钢铁的电化学腐蚀原理,在酸性环境中发生析氢腐蚀,在中性或碱性环境中发生吸氧腐蚀。
①分别写出图1中铁电极和石墨电极的电极反应式:
, 。
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在图1虚线框内所示
位置作出修改,并用箭头标出导线中电子流动方向。
③写出修改后石墨电极的电极反应式 。
(2)工业上常用盐酸除去铁锈.现将一生锈的铁片放入盐酸中,溶液中可能发生的化学反应的化学方程式有 。
(3)在实际生产中,可在铁制品的表面镀铜防止铁被腐蚀.装置示意如图2:
①A电极对应的金属是(写元素名称) ,B电极的电极反应式是 ,
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为 mol 。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 。
根据下面的反应路线及所给信息填空。
(1)A的结构简式是____________,B的结构简式是____________。
(2)反应④所用的试剂和条件是_______________________________________。
(3)反应②的化学方程式是___________________________________________,
反应⑥的化学方程式是___________________________________________。
(共6分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g) 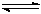 Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
(1)该反应的氧化剂是,2molN2参加反应转移电子数为。
(2) 达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。图中t4时引起平衡移动的条件可能是;图中表示平衡混合物中CO的含量最高的一段时间是。
(3)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是
(提示:272 = 729)
(共4分)合成尿素的反应是分作两步进行的:
① 2CO2(g)+ NH3(g) H2NCOONH4(aq)(氨基甲酸铵) △H =-159.47kJ/mol
H2NCOONH4(aq)(氨基甲酸铵) △H =-159.47kJ/mol
②H2NCOONH4(aq) CO(NH2)2(aq)+ H2O(l) △H =+28.49kJ/mol
CO(NH2)2(aq)+ H2O(l) △H =+28.49kJ/mol
在生产条件下,单位时间内获得尿素的产量与压强和n(NH3):n(CO2)的关系如图所示。生产过程中n(NH3):n(CO2)的最佳配比为,而实际实际生产条件下,往往使n(NH3):n(CO2)≥3,这是因为。在得到的尿素溶液中会含有少量的氨基甲酸铵,除去这种杂质最简便的方法是。
(共8分)(1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-―→2O2-)。
(1) ①c电极的名称为________,d电极上的电极反应式为。
②如图2所示电解100mL 0.5mol·L-1CuSO4溶液。若a电极产生56mL(标准状况)气体,则所得溶液的pH=_____(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入______(填字母序号)。
a.CuO b.Cu(OH)2 c.CuCO3d.Cu2(OH)2CO3
(2)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是________(填字母)。
②若用d装置保护铁,X极的电极材料应是________(填名称)。
(共7分)工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。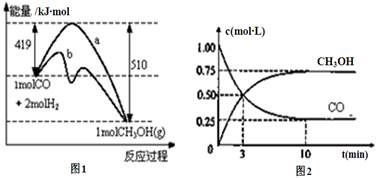
请回答下列问题:
(1)在“图1”中,曲线(填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g) CH3OH(g)的△H =。
CH3OH(g)的△H =。
(2)从反应开始到建立平衡,v(CO)=;该温度下CO(g)+2H2(g) 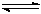 CH3OH(g)的化学平衡常数为。达到平衡后若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为。达到平衡后若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
(3)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)ΔH=- 193kJ/mol,又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式。