某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 |
K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 |
Cl- CO32— NO3— SO42— I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是___________________________________。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是________________________。
(3)甲同学最终确定原溶液中所含阳离子有________,阴离子有________;并据此推测原溶液应该呈________性,原因是____________________________(请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为____________________________。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。
有A、B、C、D、E、F六种短周期的主族元素、原子序数依次增大,其中A、D元素的原子最外电子层均只有一个电子,且A和D可形成离子化合物;C、F同主族,B元素位于元素周期表中第二周期,且原子最外层电子数占核外电子总数的3/4,F元素原子最外电子层比同周期的E元素原子的最外电子层多4个电子,请回答:
(1)写出A、D两种元素组成的化合物的电子式;
(2)写出B、D、E三种元素组成的常见化合物的名称;
(3)工业生产E的方法是;
(4)D、E、F三元素最高价氧化物对应的水化物相互之间发生反应的离子方程式为:
、
、
。
请按要求填空:
I.现有:①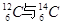 、②O2与O3、③正丁烷与异丁烷、④金刚石与石墨、⑤冰与水、⑥乙醇与二甲醚。请用序号填写对应的分类:(1)互为同位素的是;(2)互为同素异形体的是;(3)互为同分异构体的是;(4)属于同一化合物的是。
、②O2与O3、③正丁烷与异丁烷、④金刚石与石墨、⑤冰与水、⑥乙醇与二甲醚。请用序号填写对应的分类:(1)互为同位素的是;(2)互为同素异形体的是;(3)互为同分异构体的是;(4)属于同一化合物的是。
II.现有下列五种物质:①Ar②CO2③SiO2④NaOH⑤K2S,请按要求用序号填空:
(1)属于离子晶体的是,属于原子晶体的是,属于分子晶体的是;
(2)只含共价键(不含分子间作用力)的是,只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是。
已知A(g)+B(g)  C(g) +D(g) 反应过程中的能量变化如图所示,回答下列问题。
C(g) +D(g) 反应过程中的能量变化如图所示,回答下列问题。
(1)该反应是_______反应(填“吸热”、“放热”)。当反应达到平衡时,升高温度,A的转化率______(填“增大”、“减小”或“不变”),
(2)在反应体系中加入催化剂,反应速率增大,E的变化是_________,(填“增大”、“减小”或“不变”) E的大小对该反应的反应热有无影响?。
高炉炼铁中发生的基本反应之一如下:
FeO(s)+ CO (g)  Fe(s)+ CO2(g)△H>0
Fe(s)+ CO2(g)△H>0
(1)此反应的平衡常数表达式为:K=
(2)温度升高,达到新的平衡后,高炉内CO2与CO的体积比(填“增大”、“减小”或“不变”)。
(3)已知1100℃时,K= 0.263。某时刻测得高炉中c(CO2)=" 0.025" mol·L-1,c(CO)=" 0.1" mol·L-1,在这种情况下,该反应(填“向正反应方向进行”或“向逆反应方向进行”或“处于化学平衡状态”)。
(4)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,已知氢气中H-H键能为436 kJ/mol,氧气分子中 O=O键能为498 kJ/mol,则水分子中O-H键的键能为kJ/mol。若1 g水蒸气转化成液态水时放热2.5 kJ,则反应H2(g) + 1/2O2(g) ==H2O(l)的\
△H=kJ/mol
在25 ℃时,用石墨电极电解1000mL一定浓度的CuCl2溶液。5 min后电解完全,在一个石墨电极上只有1.28 g Cu生成。试回答下列问题:
(1)总反应式为。
(2)电解过程中转移的电子数为mol, 同时生成标准状况下气体的体积为
(3) 该CuCl2溶液的物质的量浓度为。
(4)有铜生成的是(填“阳极”或“阴极”)