已知:SO2(g)+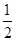 O2(g)
O2(g) SO3(g) ΔH=-98 kJ/mol。某温度下,向一体积为2 L的密闭容器中充入0.2 mol SO2和0.1 mol O2,5 min后达到平衡,共放出热量11.76 kJ,下列说法正确的是( )
SO3(g) ΔH=-98 kJ/mol。某温度下,向一体积为2 L的密闭容器中充入0.2 mol SO2和0.1 mol O2,5 min后达到平衡,共放出热量11.76 kJ,下列说法正确的是( )
| A.5 min内用O2表示的反应速率为0.12 mol/(L·min) |
| B.该反应的平衡常数数值为7.5 |
| C.SO2的平衡转化率为60% |
| D.加入催化剂,可使ΔH变小 |
38.4g铜跟适量的浓硝酸反应,铜完全作用后,共收集到气体22.4L(标准状况),反应消耗的HNO3的物质的量可能是
| A.1.0mol | B.1.6 mol | C.2.2 mol | D.2.4 mol |
下列事实能证明氯比硫非金属性强的是
| A.HClO3稳定,H2SO3不稳定 | B.HClO4比H2SO3酸性强 |
| C.HCl溶液是强酸,H2S溶液是弱酸 | D.Fe与Cl2生成FeCl3,Fe与S生成FeS |
A、B、C、D四个集气瓶中分别装有Cl2、H2、HCl、HBr中的任一种气 体,若A、D两气体混合见光爆炸,A、B两瓶气体混合瓶壁上出现深红棕色小液滴,则C瓶装的气体是
体,若A、D两气体混合见光爆炸,A、B两瓶气体混合瓶壁上出现深红棕色小液滴,则C瓶装的气体是
A.HBr B.HCl C.Cl2D.H2
下列离子方程式书写正确的是
A.实验室用氯化铵和熟石灰制氨:NH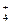 + OH- + OH-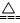 NH3↑+H2O NH3↑+H2O |
B.NaOH与NH4Cl溶液混合加热:NH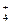 + OH- + OH- NH3·H2O NH3·H2O |
C.氨水中加盐酸:NH3·H2O+H+="=" NH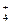 +H2O +H2O |
D.氨水中通入少量CO2:CO2+2NH3·H2O="==" 2NH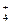 +CO +CO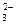 + H2O + H2O |
已知某溶液中存在较多的H+、SO 、NO
、NO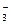 ,则在该溶液中不能大量存在的离子组是
,则在该溶液中不能大量存在的离子组是
①K+、NH 、F-②K+、Ba2+、Cl-③K+、Na+、I-④K+、Na+、ClO-
、F-②K+、Ba2+、Cl-③K+、Na+、I-④K+、Na+、ClO-
| A.①②③④ | B.只有②③④ | C.只有①③④ | D.只有②③ |