Ⅰ.在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,CO和H2O浓度变化如图所示:
CO2(g)+H2(g) ΔH<0,CO和H2O浓度变化如图所示:
(1)0~4 min的平均反应速率v(CO)=________mol/(L·min),反应在第5 min时的平衡常数K=________。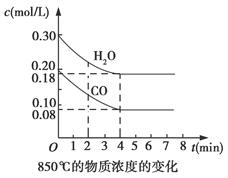
t℃时物质浓度(mol/L)的变化
| 时间(min) |
CO |
H2O |
CO2 |
H2 |
| 0 |
0. 200 |
0. 300 |
0 |
0 |
| 2 |
0. 138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
| 5 |
0. 116 |
0. 216 |
0. 084 |
|
| 6 |
0. 096 |
0. 266 |
0. 104 |
|
(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表所示:
①表中3~4 min之间反应处于________状态;c1数值________(填“>”“=”或“<”)0.08 mol/L。
②反应在4~5 min间,平衡向逆反应方向移动,可能的原因是________(填标号,下同),表中5~6 min之间数值发生变化,可能的原因是________。
A.增加水蒸气B.降低温度C.使用催化剂D.增加氢气浓度
Ⅱ.在热的稀硫酸中溶解了11.4 g硫酸亚铁固体,当加入50 mL 0.5 mol/L的KNO3溶液后,使其中的Fe2+全部转化成Fe3+、KNO3也完全反应并放出NxOy气体。
(3)推算出x=________,y=________。
(4)写出该反应的化学方程式:________________(x、y用具体数值表示)。
(5)反应中氧化产物是________。
下表为元素周期表的一部分,参照元素①~⑩在表中的位置,请用化学用语作答:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
⑤ |
||||
| 3 |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
(1)⑤、⑥、⑦的离子半径由大到小的顺序为。(填离子符号)
(2)⑧、⑨、⑩的最高价含氧酸的酸性由强到弱为。(用化学式表示)
(3)写出⑥在空气中加热生成的产物的电子式:。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。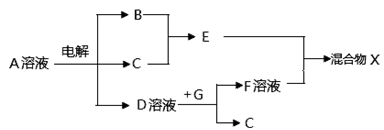
①写出D溶液与G反应的化学方程式。
②混合物X中的某物质不溶于水,但既能溶于酸又能溶于碱,请写出它在碱性溶液中的电离方程式。
(5)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式:。
(6)砷(As)的化合物可用于杀虫及医疗。
①As的原子结构示意图为。
②Y由④⑥⑩三种元素组成,是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为。
氧化还原反应中实际包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-→NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_____________________________
(2)反应中硝酸体现了、性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是mol。
现有:①硫酸铜②碳酸钙固体③磷酸④硫化氢⑤三氧化硫⑥金属镁⑦石墨⑧苛性钾⑨NH3·H2O⑩石灰水,其中属于强电解质的是,属于弱电解质的是,属于非电解质的是,既不是电解质,又不是非电解质的是。(填序号)
【化学---选修5有机化学基础】15分
已知两个羟基同时连在同一个碳原子上时结构是不稳定的,它将发生脱水反应,例如:CH3CH(OH)2→CH3CHO +H2O,现有分子式为C9H8O2Br2的物质M,已知E的化学式为C7H5O2Na,A的相对分子质量为46,在一定条件下可发生下列一系列反应: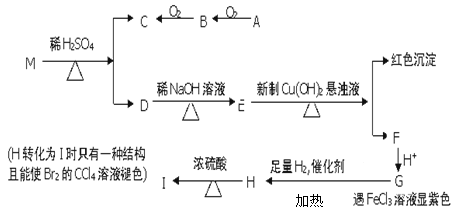
请回答下列问题
(1)B中官能团的名称,A的核磁共振氢谱有个吸收峰;G→H的反应类型。
(2)M的结构简式
(3)写出下列反应的化学方程式
①A→B②H→I
(4)同时符合下列条件的G的同分异构体的结构简式有种,写出其中一种的结构简式
| A.分子中含有苯环 | B.能发生水解反应 |
| C.能发生银镜反应 | D.与FeCl3溶液反应显紫色 |
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子。A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层电子数的3倍,B、C的最外层电子数之和与D的最外层电子数相等。E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏。请回答下列问题:
(1)C的最高价氧化物对应水化物中含有的化学键类型为。
(2)写出由AB两种元素组成1:1化合物的电子式
(3)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为 ________________________________ 。
(4)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是(填序号)。
①保存ED2溶液时,需向溶液中加入少量E单质和AD溶液
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色