下表为元素周期表的一部分,参照元素①~⑩在表中的位置,请用化学用语作答:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
② |
|
|
③ |
④ |
⑤ |
|
| 3 |
⑥ |
|
⑦ |
|
⑧ |
⑨ |
⑩ |
|
(1)⑤、⑥、⑦的离子半径由大到小的顺序为 。(填离子符号)
(2)⑧、⑨、⑩的最高价含氧酸的酸性由强到弱为 。(用化学式表示)
(3)写出⑥在空气中加热生成的产物的电子式: 。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。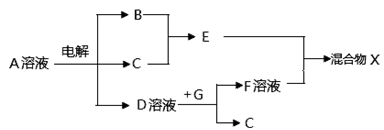
①写出D溶液与G反应的化学方程式 。
②混合物X中的某物质不溶于水,但既能溶于酸又能溶于碱,请写出它在碱性溶液中的电离方程式 。
(5)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式: 。
(6)砷(As)的化合物可用于杀虫及医疗。
①As的原子结构示意图为 。
②Y由④⑥⑩三种元素组成,是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为 。
已知下列物质:①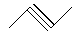 ,②
,② ,③
,③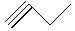 ,④
,④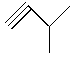 ,⑤
,⑤
请按要求填空:
(1)写出①④的名称________、________;
(2)写出②、⑤的分子式________、________;
(3)互为同分异构体的是________;互为同系物的是_______
(4)写出③与等物质的量的Br2反应的化学方程式:_____________________。
有机化学中的反应类型较多,将下列反应归类(填序号)。
①由乙炔制氯乙烯
②乙烷在空气中燃烧
③乙烯使溴的四氯化碳溶液褪色
④乙烯使酸性高锰酸钾溶液褪色
⑤由乙烯制聚乙烯
⑥甲烷与氯气在光照的条件下反应
⑦用甲苯制三硝基甲苯
⑧甲苯使酸性高锰酸钾溶液褪色
其中属于取代反应的是__________;属于氧化反应的是__________;属于加成反应的是__________;属于聚合反应的是__________。
二氧化碳是一种宝贵的碳氧资源。以CO2和NH3为原料合成尿素是固定和利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s) △H1=-159.47kJ·mol-1
NH2CO2NH4(s) △H1=-159.47kJ·mol-1
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
请回答下列问题:
(1)下列示意图中,能正确表示尿素合成过程中能量变化曲线是 。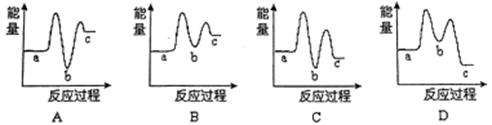
[a表示2NH3(g)+CO2(g),b表示H2NCOONH4(s),c表示CO(NH2)2(s)+H2O(g)]
反应Ⅲ在 (填“较高温度”或“较低温度”)下能自发进行。
(2)反应中影响CO2转化率的因素很多,下图甲为一定条件下,不同水碳比n(H2O)/n(CO2)和温度影响CO2转化率变化的趋势曲线。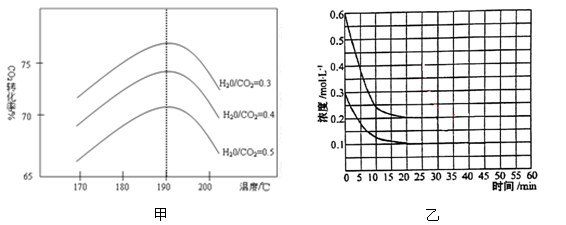
①其他条件相同时,为提高CO2的转化率,生产中可以采取的措施是 (填“提高”或“降低”)水碳比。
②当温度高于190℃后,CO2转化率出现如图甲所示的变化趋势,其原因是 。
(3)根据反应Ⅰ,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入体积为10L的密闭容器中(容器体积不变,固体体积忽略不计),经20min达到平衡,反应物浓度的变化曲线如图乙所示,若保持温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在图乙中画出25~45min内氨气的浓度变化曲线。
(4)尿素在土壤中会发生反应CO(NH2)2+2H2O (NH4)2CO3。
(NH4)2CO3。
①下列物质中与尿素有类似性质的是 。
| A.H2NCOONH4 | B.HOCH2CH2OH |
| C.HOCH2CH2NH2 | D.H2NOCCH2CH2CONH2 |
②已知电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 |
H2CO3 |
NH3·H2O |
| 电离平衡常数 |
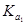 =4.30×10-7 =4.30×10-7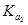 =5.60×10-117 =5.60×10-117 |
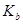 =5.60×10-117 =5.60×10-117 |
则常温下0.1mol·L-1的(NH4)2CO3溶液呈碱性的原因 。
Ⅰ.在甲溶液中通入过量CO2生成乙和另一种具有漂白性的物质,在乙溶液中滴加某钠盐溶液丙可以生成丁溶液(丁溶液呈中性),同时产生无色气体,已知题中所涉及的物质皆为中学化学中常见物质。回答下列问题:
(1)甲的化学式为 。
(2)写出乙在医疗上的一个用途 。
(3)在乙溶液中滴加丙溶液生成丁溶液的离子方程式 。
Ⅱ.固体化合物X由四种常见的短周期元素组成,可用作牙膏中的添加剂。现取39.3g化合物X进行如下实验: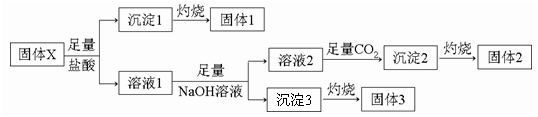
实验结束后得到15.3g固体2和6.0g固体3,且固体1、固体2、固体3都可用作耐高温材料。回答下列问题:
(1)NaOH的电子式为 ,沉淀2的化学式为 。
(2)固体X的化学式为 。
(3)溶液1中加入足量NaOH溶液,反应的化学方程式为 。
(4)在高温下,固体3中某元素的单质可以与固体1发生置换反应,请写出此反应的化学方程式 。
(5)设计一个实验方案,比较固体2和固体3中两不同元素对应单质的活动性强弱 。
【化学—选修5有机化学基础】某芳香烃A是有机合成中非常重要的原料,通过质谱法测得其最大质荷比为118;其核磁共振氢谱中有5个峰,峰面积之比为1:2:2:2:3;其苯环上只有一个取代基。以下是以A为原料合成高分子化合物F、I的路线图,试回答下列问题: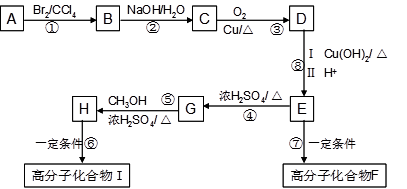
(1)A的结构简式为 。
(2)D中的官能团名称是 。
(3)I的结构简式为 。
(4)上述反应中属于取代反应的是 。
(5)反应⑥、⑦生成的高分子化合物的反应原理是否相同 。
(6)写出下列反应的化学方程式:
反应⑤ ;反应⑦ 。
(7)符合以下条件的D的同分异构体有 种(不考虑立体异构)。
| A.苯环上有两个取代基 | B.苯环上的一氯代物有两种 |
| C.加入三氯化铁溶液不显色 | D.能发生银镜反应 |