二氧化碳是一种宝贵的碳氧资源。以CO2和NH3为原料合成尿素是固定和利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s) △H1=-159.47kJ·mol-1
NH2CO2NH4(s) △H1=-159.47kJ·mol-1
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
请回答下列问题:
(1)下列示意图中,能正确表示尿素合成过程中能量变化曲线是 。
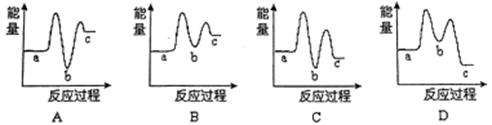
[a表示2NH3(g)+CO2(g),b表示H2NCOONH4(s),c表示CO(NH2)2(s)+H2O(g)]
反应Ⅲ在 (填“较高温度”或“较低温度”)下能自发进行。
(2)反应中影响CO2转化率的因素很多,下图甲为一定条件下,不同水碳比n(H2O)/n(CO2)和温度影响CO2转化率变化的趋势曲线。
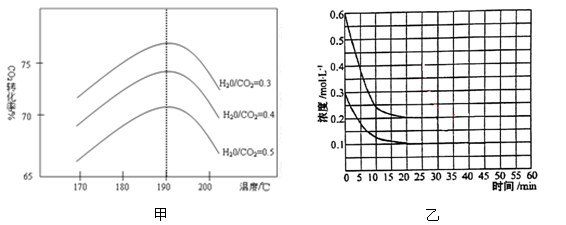
①其他条件相同时,为提高CO2的转化率,生产中可以采取的措施是 (填“提高”或“降低”)水碳比。
②当温度高于190℃后,CO2转化率出现如图甲所示的变化趋势,其原因是 。
(3)根据反应Ⅰ,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入体积为10L的密闭容器中(容器体积不变,固体体积忽略不计),经20min达到平衡,反应物浓度的变化曲线如图乙所示,若保持温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在图乙中画出25~45min内氨气的浓度变化曲线。
(4)尿素在土壤中会发生反应CO(NH2)2+2H2O (NH4)2CO3。
(NH4)2CO3。
①下列物质中与尿素有类似性质的是 。
| A.H2NCOONH4 | B.HOCH2CH2OH |
| C.HOCH2CH2NH2 | D.H2NOCCH2CH2CONH2 |
②已知电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 |
H2CO3 |
NH3·H2O |
| 电离平衡常数 |
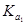 =4.30×10-7 =4.30×10-7 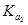 =5.60×10-117 =5.60×10-117 |
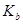 =5.60×10-117 =5.60×10-117 |
则常温下0.1mol·L-1的(NH4)2CO3溶液呈碱性的原因 。
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
(1)从反应开始到10 s,用Z表示的反应速率为________________________。
X的物质的量浓度减少了____________,Y的转化率为_________________。
(2)该反应的化学方程式为____________________________________。
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示:
则下列说法符合该图像的是________。
| A.t1时刻,增大了X的浓度 |
| B.t1时刻,升高了体系温度 |
| C.t1时刻,缩小了容器体积 |
| D.t1时刻,使用了催化剂 |
(本题共14分)
火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害。对烟气中CO2、CO、SO2等物质进行回收利用意义重大。
(1)“湿式吸收法”利用吸收剂与烟气中的SO2发生反应从而脱硫,其中“钠碱法”用NaOH溶液作吸收剂,向100mL0.2mol·L-1的NaOH溶液中通入标准状况下0.448LSO2气体,反应后测得溶液pH<7.则溶液中下列各离子浓度关系正确的是(填字母序号).
A.c(HSO3-)>c(SO32-)>c(H2SO3)
B.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
C.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
(2)CO2是一种温室气体,人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下: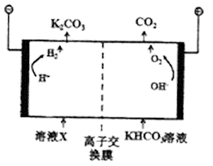
①在阳极区发生的反应包括和H++HCO3-=CO2↑+H2O.
②简述CO32-在阴极区再生的原理.
(3)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25℃,101kP下:
① H2(g)+1/2O2(g)=H2O(g)△H1=-242kJ/mol
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H2="-676" kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式.
(4)已知反应:CO(g)+H2O(g) H2(g)+CO2(g);△H=-41.2kJ/mol.生成的CO2与H2以不同的体积比混合时在合适的条件下反应可制得CH4.
H2(g)+CO2(g);△H=-41.2kJ/mol.生成的CO2与H2以不同的体积比混合时在合适的条件下反应可制得CH4.
①850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O(g),CO和H2O(g)浓度变化如右图所示。下列说法正确的是(填序号).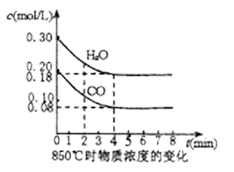
A.达到平衡时,反应体系最终会放出49.44kJ热量
B.第4min时,混合气体的平均相对分子质量不再变化,可判断已达到化学平衡
C.第6min时,若升高温度,反应平衡常数会增大
D.第8min时,若充入CO,会导致v(正)>v(逆),平衡向正反应方向移动
E.0~4min时,CO的平均反应速率为0.030mol/(L•min)
②熔融盐燃科电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。负极反应式为.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,为此电池工作时必须有部分A物质参加循环,则A物质的化学式是.
(本题由I、II两部分组成,共16分)
【I】常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常量下的无色无味气体。则甲的电子式为;丁溶于水时发生反应离子方程式为.
(2)若丁为能使品红褪色的无色气体,丙为常见红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。
①写出生成丙的化学方程式.
②向MCl2溶液中通入气体丁有白色沉淀(MCl)产生,该反应的离子方程式为.
【Ⅱ】A、B、C、D均为中学化学中的常见物质,请根据题中信息回答下列问题:
(3)若它们存在如下反应转化关系:A+B→C+D(未配平,反应条件略去)。该转化关系中所涉及的反应为非置换反应,且A、D分子的核外电子总数都为10个,B与C能发生反应,则反应的方程式是。
(4)若它们存在如下反应转化关系:A+B→C+D+H2O(未配平,反应条件略去).
①该转化关系中所涉及的反应为氧化还原反应。若C、D两种气体均能使澄清石灰水变浑浊,鉴别C、D两种气体不能选用下列试剂中的(填写字母编号).
A.Ba(OH)2溶液
B.酸性KMnO4溶液
C.紫色石蕊试液
D.H2O2与BaCl2混合液
E.酸化的Ba(NO3)2溶液
②该转化关系中所涉及的反应为非氧化还原反应。若A是造成温室效应的主要气体之一,C、D均为钠盐,D与B反应能转化为C。当参加反应的A、B物质的量之比为3:4时,则反应所得溶液中各种离子的浓度由大到小的顺序为.
③若该反应为氧化还原反应,A是一种气体,B、D溶液显碱性,且D溶液具有强氧化性,则在绿矾溶液中加入少量D溶液,发生反应的离子方程式为.
(本体包括I、II两部分,共14分)
【I】工业上用CO2和NH3为原料合成尿素,尿素的化学式为CO(NH2)2。尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(III),化学式为[Fe(H2NCONH2)6](NO3)3。
(1)C、N、O三种元素的第一电离能由大到小的顺序是.
(2)尿素分子中C和N原子的杂化方式分别是。
(3)NH4+中H—N—H键角比NH3中H—N—H键角大,原因为.
【Ⅱ】在元素用期表中,某稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7。其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层层电子数为18.E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点量高。
(4))B元素在周期表中的位置;D元素的价电子排布式为.
(5)已知B离子类似Cu2+与NH3形成配合离子,且两者配位数也相同,1mol该配离子中含有molσ键。
(6)A元素可与E元素形成离子化合物,它的晶胞如图所示,E离子的配位数为。每个A离子周围与之最近等距的A离子有个.
(7)已知铜元素能形成多种化合物。
①CuSO4·5H2O也可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下图所示。下列说法正确的是(填字母).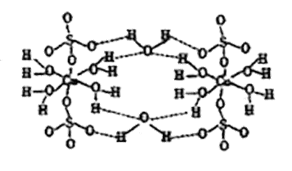
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.该晶体中电负性最大的元素是O
C.该晶体属于原子晶体
D.该晶体中的水在不同温度下会分步失去
②YBCD-12也是一种含Cu元素的化合物,化学式为YBa2Cu3O6.95。已知该化合物中各元素的化合价为:Y为+3价、Ba为+2价、O为—2价、Cu为+2价和+3价。则该化合物中+2价Cu和+3价Cu的原子个数之比为.
[化学选修5—有机化学基础] (15分)
紫杉醇(paclitaxel)是一种抗癌药,化合物D是紫杉醇的侧链,D的合成路线如图: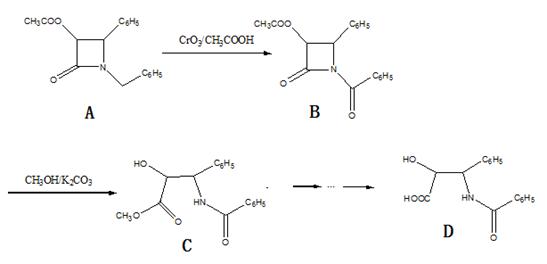
(1)B的分子式为_______;D的水解产物中所含官能团的名称为_____________________。
(2)已知酯和酰胺在过量醇中能发生醇解反应:
CH3COOC2H5+CH3OH CH3COOCH3+C2H5OH
CH3COOCH3+C2H5OH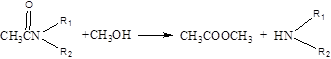
A-B的反应类型为_______________,B-C的反应类型为_______________。
(3)B-C反应的另一产物为______________________(写结构简式)
(4)A的合成应用了2010年诺贝尔化学奖的获奖成果﹣﹣交叉偶联反应,反应式如下(已配平):
CH3COOCH2COCl+X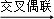 A+HCl,X分子中含碳氮双键(C=N),其结构简式为.
A+HCl,X分子中含碳氮双键(C=N),其结构简式为.
(5)若最后一步水解的条件控制不好,D会继续水解生成氨基酸E和芳香酸F.
①写出D在NaOH溶液中发生水解的化学反应方程式_________________________.
②E在一定条件下能发生缩聚反应,写出所得高分子化合物的一种可能的结构简式:
③F的同分异构体中,属于芳香族化合物、能发生银镜反应的有______种.