(1)把CoCl2溶于水后加氨水直到先生成的Co(OH)2沉淀又溶解后再加氨水,使生成2+,此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示。把分离出CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1mol CoCl3·5NH3只生成2molAgCl。请写出表示此配合物结构的化学式: 此配合物中的Co化合价为
(2)主族元素R的最高价氧化物R2O 4.7g溶于95.3g水中,所得溶液的质量分数为5.6%,R原子核中含有20个中子;主族元素Q,其单质与水剧烈反应放出O2,并能跟R形成典型离子化合物RQ。R的元素名称是_______,Q单质与水反应的化学方程式为______________。将4.7g R2O溶于_______g水中,可使每50个水分子中溶有1个R+离子。
用离子交换法从海带中提取碘是一种较为先进的制碘工艺应用技术。
①浸泡海带:取海带500g,加13~15倍水量分两次浸泡,得浸出液6000mL左右,碘含量为0.5g/L。
②碱化浸出液除褐藻糖胶:即海带浸出液1000mL,加入浓度为40% 的NaOH溶液,控制pH值为12左右,充分搅拌后使褐藻酸钠絮状沉淀而沉降。采用倾析法分离出清液。
③氧化游离:向上述清液中加入浓度为6mol× L-1的H2SO4溶液,使pH值为1.5~2。往酸化后溶液中加入NaClO溶液或H2O2溶液,充分搅拌并观察溶液颜色变化。待溶液由淡黄逐渐变成棕红色即表明I-离子已转变为多碘离子(I3-)。
④交换吸附:氯型强碱性阴离子交换树脂(R—Cl表示)注入交换柱中(树脂层高度为12cm),如右图连接交换装置,待溶液全部通过后,树脂颜色变为黑红色。
⑤洗脱:分两步进行
第一步:取8~10% 的NaOH溶液40mL注入交换柱中。在强碱作用下,树脂颜色逐渐变浅,待树脂基本褪色后,放出溶液,收集于一小烧杯中为碱性洗脱液。
第二步:取10% 的NaCl溶液40mL注入上述交换柱中。稍待一会儿,慢慢放出溶液收集于另一小烧瓶中,为氯化钠洗脱液。
⑥往碱性洗脱液中滴加H2SO4溶液(6mol/L),烧杯底部会析出一层泥状粗碘。
⑦往氯化钠洗脱液中滴加H2SO4溶液(6mol/L)使之酸化,再滴加10% 的NaNO2溶液(在通风橱中进行)。待溶液由无色转变为棕红色直至出现棕黑色浑浊。
⑧离心分离即得粗碘。
试回答下列问题
(1)步骤③在酸性条件下用NaClO(或H2O2)氧化碘的离子方程式: ,
及I2 +I- I3-。如何用化学方法检验有多碘离子生成。
I3-。如何用化学方法检验有多碘离子生成。
(2)第④步发生的离子反应为:。
(3)步骤⑤洗脱时第一步发生的离子反应为(洗脱液中含有I-和IO3-离子):
;第二步洗脱发生的离子反应为:。
(4)步骤⑦发生反应的离子方程式为 。
为了比较温室效应气体对目前全球增温现象的影响, 科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。
结合表中列出的九种气体,试参与回答下列各题:
(1)下列由极性键形成的极性分子是 。
A.N2 B.O2 C.H2O D.CO2E.CH4
(2)下列说法不正确的是。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是 。
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B. C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构D.第一电离能:N<O<F
(4)甲烷晶体的晶胞结构如右图,下列有关说法正确的是。
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C. CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体
(5)水能与多种过渡金属离子形成络合物,已知某红紫色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成, 且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为。
A. [ CoCl2(NH3)4 ]Cl·NH3·H2O; B. [ Co(NH3)5(H2O)]Cl3;
C. [ CoCl2(NH3)3(H2O)]Cl·2NH3; D.[ CoCl(NH3)5]Cl2·H2O。
(6)题(5)中钴离子在基态时核外电子排布式为:。
经研究发现有白蚁信息素有: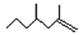 (2,4-二甲基-1-庚烯) ,
(2,4-二甲基-1-庚烯) ,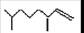 (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)2CH=CH—CH=CH(CH2)8CH3。试完成下列问题:
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)2CH=CH—CH=CH(CH2)8CH3。试完成下列问题: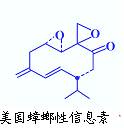
(1)下列说法正确的是。
| A.以上三种信息素互为同系物 | B.以上三种信息素均能使溴的四氯化碳溶液褪色 |
| C.2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同系物 | |
| D.家蚕信息素与1molBr2加成产物只有一种 |
(2)烯烃A是2,4-二甲基-1-庚烯的一种同分异构体,A与足量氢气加成得到烷烃B,B的一氯代物只有2种;烯烃C是3,7-二甲基-1-辛烯的一种同分异构体,C与氢气加成得到烷烃D,D的一氯代物也只有2种,则B的结构简式为:。C的结构简式为:。
(3)美国蟑螂性信息素结构式如右图,分子中含有手性碳原子 个;有机物E与该信息素互为同分异构体,E能发生银镜反应又能与碳酸氢钠溶液反应,若E表示为: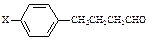 ,X可能的结构有种。
,X可能的结构有种。
马格尼特法冶炼镁的工艺流程如下图。炉料中除有煅烧白云石和硅铁外,还加入煅烧过的铝土矿,加Al2O3的主要目的是降低渣的熔点,便于液态排渣。
已知白云石的成分为CaCO3·MgCO3,硅铁是指含有55%硅左右的铁[可表示为Si(Fe)],作还原剂,最后得到低品位的硅铁[可表示为Fe(Si)],简易流程图如下
试回答下列问题
(1)反应①,白云石煅烧得CaO·MgO的化学方程式为:。
(2)反应②,还原炉中发生反应生成镁和炉渣的化学方程式为:。
(3)该成分的沪渣是一种工业生产的重要原料,可作为生产原料。
(4)马格尼特法冶炼镁,一台4500千瓦的炉子可日产约7.2吨镁,一天至少约消耗含硅60%的硅铁吨。
已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体,Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁铁矿的主要成分,D、H、K均是重要的工业产品,X分子的球棍模型如图所示,图中部分反应条件已略去。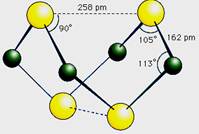
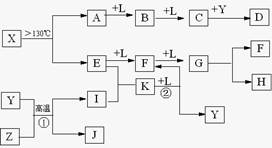
试回答下列问题
(1)写出化学式:DX 。
(2)E的电子式为:。
(3)写出化学方程式:①;②。