I.有A、B、C、D四种短周期元素,其中A、D同主族;又已知B和A可形成组成为BA的化合物,其中A的化合价为-1,B和C可形成组成为B2C2的化合物,A、B、C形成的单核离子的核外电子总数相同。
(1)元素A在周期表中的位置是 。
(2)B、C、D可形成组成为BDC的化合物,该化合物水溶液中通入过量CO2发生反应的离子方程式为 。
(3)B2C2在酸性条件下可形成具有二元弱酸性质的物质,该弱酸性物质和B的最高价氧化物对应水化物反应时可生成一种酸式盐,该酸式盐的电子式为 。
II.长期以来一直认为氟的含氧酸不存在。但是自1971年斯图杰尔和阿佩里曼(美)成功地合成了次氟酸后,这种论点被剧烈地动摇了。他们是在0℃以下将氟化物从细冰末的上面通过,得到毫克量的次氟酸。已知次氟酸的分子构成与次氯酸相仿。
⑴次氟酸中氧元素的化合价为 。
⑵下面给出了几个分子和基团化学键的键能(E):
| |
H2 |
O2 |
F2 |
O-H |
O-F |
H-F |
| E/(kJ/mol) |
432 |
494 |
155 |
424 |
220 |
566 |
请计算反应:2HFO=2HF+O2的反应热(△H)的近似值为 kJ/mol。
⑶次氟酸刹那间能被热水所分解,生成一种常见的物质H2O2,写出次氟酸与热水反应的化学方程式: 。
(4)1986年,化学家Karl Christe首次用2K2MnF6 + 4SbF5 ="==" 4KSbF6 + 2MnF3 + F2↑化学方法制得了F2。该反应中被还原的元素化合价从 价变为 价,若反应中生成标准状况下11.2 L的F2,则有 mol电子发生转移。
(10分)对于A+2B(气)  nC(气)+Q在一定条件下达到平衡后,改变下列条件,请回答:
nC(气)+Q在一定条件下达到平衡后,改变下列条件,请回答:
(1)A量的增减,平衡不移动,则A为______态。
(2)增压,平衡不移动,当n=2时,A的状态为________;当n=3时,A的状态为______。
(3)若A为固体,增大压强,C的组分含量减少,则____。
(4)升温,平衡向右移动,则该反应的逆反应为________反应。
在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间 |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
| c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为_________________________________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol•L-1•s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L-1。
根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是
________________________________________________________________________
(2)图是198 K时N2与H2反应过程中能量变化的曲线图。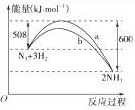
该反应的热化学方程式为:_____________________________________________________
(3)写出以下物质的电离方程式:
NaHCO3__________________________________________,
CH3COONH4_____________________________________,
H2CO3_____________________________________________
判断下列说法是否正确(正确的在括号内打“√”错误的打“×”)
①中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠少于醋酸;()
②将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的 ;()
;()
③如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍;()
④物质的量相同的磷酸钠溶液和磷酸溶液中所含的PO3-4量相同。()
下列盐溶液能发生水解的用离子方程式表示,不能发生水解的写“不发生水解”字样,并说明溶液的酸碱性
K 2CO3, 溶液呈性;
Na2SO4, 溶液呈性;
CuCl2, 溶液呈性。