某研究性学习小组的同学通过课外学习了解到:某品牌牙膏中含有摩擦剂、湿润剂、表面活性剂、黏合剂、香料、甜味剂等成分,其中的摩擦剂除了含CaCO3外,可能还含有Al(OH)3、SiO2中的一种或两种。为探究该品牌牙膏中摩擦剂的成分,该小组的同学进行了如下实验(牙膏中其他成分遇到盐酸时无气体产生):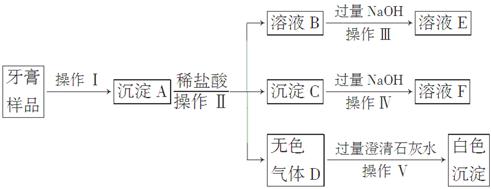
请回答下列问题:
(1)操作Ⅰ中涉及的玻璃仪器有烧杯、________、________。
(2)写出下列操作过程涉及的离子方程式:
操作Ⅲ:______________________________,
操作Ⅳ:______________________________。
(3)该摩擦剂中除CaCO3外,肯定含有__________________。
(4)为进一步探究摩擦剂中碳酸钙的含量,该小组同学利用如图所示装置(图中夹持仪器略去)进行实验。
请回答下列问题:
①实验过程中需持续缓缓通入空气。其作用除了可充分混合装置乙和丙中的反应物外,还有________的作用;
②丙中主要反应的化学方程式是________________;
③实验中准确称取4.00 g样品三份,进行三次测定,测得BaCO3的平均质量为1.97 g,计算样品中碳酸钙的质量分数(要求有计算过程):__________________________;
④有同学认为只要测定装置丙在吸收CO2前后的质量差,不必测定装置丙中生成的BaCO3质量,一样可以确定碳酸钙的质量分数。你认为该方案是否可行?________,简述理由:________。
(8分)某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响。
已知:2NO2(g) N2O4(g) ΔH(298 K)=-52.7 kJ·mol-1
N2O4(g) ΔH(298 K)=-52.7 kJ·mol-1
(1)该化学反应的浓度平衡常数的表达式为__________________。
(2)该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如右图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。
请回答:
①A中的现象为____________________
②由上述实验现象可知,降低温度,该反应化学平衡向_____________(选填“正”或“逆”)反应方向移动。
③升高温度,该反应的化学平衡常数将_____________(选填“增大”“减小”或“不变”)。
50 mL 0.50 mol・L-1盐酸与50 mL 0.55 mol・L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
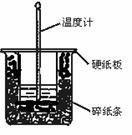
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验改用60 mL 0.50 mol・L-1盐酸跟50 mL 0.55 mol・L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理由: 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50 mol・L-1NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)
化学兴趣小组设定以下实验方案,测定某已变质为碳酸钠的小苏打样品中NaHCO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:
(2)实验中需加热至恒重的目的是:
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为
(2)实验中判断沉淀是否完全的方法是
方案三:按如图装置进行实验:
(1)B装置内所盛试剂是 ;D装置的作用是 ;分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为 。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:________
某课外活动小组将下图所示装置按一定顺序连接,,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。
请回答下列问题:
(1)A中发生反应的化学方程式为____________________
(2)各装置的连接顺序为(填写装置代号)A→_______→ ________→_______→D。
(3)装置C的作用是________________写出装置D中反应的离子方程式__________________
(4)反应开始后,B中硬质玻璃管内的现象为________________可以检验生成物中含有Fe3+的试剂是__________(填写试剂名称)。
(5)该小组欲用下图所示装置收集尾气,并测量多余气体的体积。
①若下图所示量气装置由于燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是________(填“酸式”或“碱式”)滴定管。
②为提高测量的准确性,下图装置中的液体可用______,收集完气体后,读数前应进行的操作是_____。
③如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致体积______(填“偏大”“偏小”或“无影响”)。
溴化钙是一种无色斜方针状结晶或晶块,无臭,味咸而苦。医药上用作中枢神经抑制药,具有抑制、镇静作用,用以治疗神经衰弱、癫痫等症。工业用溴化亚铁法制备,其流程如下:
(1)与液溴的反应温度不能超过40℃的原因是 。
(2)滤渣的成分可能是 。
(3)试剂M是 ,加入M的目的是 。
(4)操作Ⅱ的步骤为蒸发浓缩、 、洗涤、干燥
(5)将氨气通入石灰乳,加入溴,于65°C进行反应也可制得溴化钙,此反应中还会生成一种无色气体,写出反应的化学方程式 。
(6)制得的CaBr2·2H2O可以通过以下方法测定纯度:称取5.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却,称量。得到2.00g固体,则CaBr2·2H2O的质量分数为 。