1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
| A.该合金中铜与镁的物质的量之比是2:1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
在化学学科中经常使用下列物理量,其中跟阿伏加德罗常数(N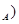 无关的组合是
无关的组合是
①相对原子质量 ②摩尔质量(M)③原子半径(r)④物质的量(n)⑤气体摩尔体积(V
②摩尔质量(M)③原子半径(r)④物质的量(n)⑤气体摩尔体积(V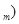
⑥溶解度(S)⑦溶质的质量分数(w)
| A.①③⑥⑦ | B.②④⑤⑥ | C.①②③⑤ | D.②③⑤⑥⑦ |
设N 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是
A.4.6 g组成为 的有机物,所含C—H键数目一定为0.6N 的有机物,所含C—H键数目一定为0.6N |
B.8.7 g 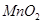 与40 mL 10 与40 mL 10 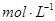 的浓盐酸充分反应,生成的氯气分子数为0.1N 的浓盐酸充分反应,生成的氯气分子数为0.1N |
C.1 mol  中含有的阴、阳离子总数是3N 中含有的阴、阳离子总数是3N 而1 mol 而1 mol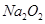 中含有的阴、阳离子总数是4N 中含有的阴、阳离子总数是4N |
D.在反应  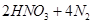 ↑ ↑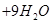 中,每生成4 mol 中,每生成4 mol  转移电子数为15N 转移电子数为15N |
下图所示为2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是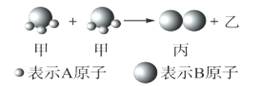
| A.根据阿伏加德罗定律可推知,1个乙分子中含有2个A原子 | B.该反应类型是分解反应 |
| C.反应生成的丙物质属于单质 | D.化学反应中分子的种类发生了改变 |
25℃时,几种弱酸的电离常数如下:
| 弱酸的化学式 |
CH3COOH |
HCN |
H2S |
| 电离常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=1.3×10-7 K2=7.1×10-15 |
25℃时,下列说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)> pH(Na2S) > pH(NaCN)
B.a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度的NaCN溶液的pH=d,则其中由水电离出的c(H+)=10-dmol/L
下列物质间转化都能通过一步实现的是
| A.Si→SiO2→H2SiO3→Na2SiO3 |
| B.Al→Al2O3→NaAlO2→Al(OH)3 |
| C.S→SO3→H2SO4→SO2 |
| D.N2→NO2→HNO3→NO |