室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=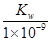 mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
当CH3COOH  H+ + CH3COO-已达平衡,若要使醋酸的电离程度和溶液的pH都减小,应加入的试剂是()
H+ + CH3COO-已达平衡,若要使醋酸的电离程度和溶液的pH都减小,应加入的试剂是()
| A.CH3COONa | B.NH3·H2O | C.HCl | D.H2O |
反应 A+B →C(△H <0)分两步进行① A+B→X (△H >0)② X→C
(△H <0)下列示意图中,能正确表示总反应过程中能量变化的是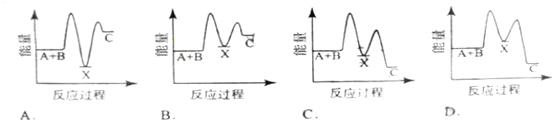
下列溶液加热蒸干灼烧后,能析出溶质固体的是
| A.AlCl3 | B.KHCO3 | C.Fe2(SO4)3 | D.NH4HCO3 |
下列说法正确的是
| A.盐溶液不是促进就是抑制水的电离 | B.弱酸对水的抑制作用就比强酸弱得多 |
| C.催化剂能改变可逆反应达到平衡的时间 | D.硫酸氢钠溶液显酸性,是因为电离大于水解 |
已知温度T时水的离子积常数为KW。该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a = b |
| B.混合溶液的pH = 7 |
C.混合溶液中,c(H+) = 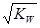 mol/L mol/L |
| D.混合溶液中,c(H+) + c(B-) = c(OH-) + c(A-) |