许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1)重晶石(BaSO4)常做胃肠道造影剂。
已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)= __。
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。
①检验晶体中含有NH4+的方法为 。
②等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4
c.(NH4) 2SO4 d.(NH4)2SO3,
其中c(NH4+)由大到小的顺序为 __(填选项字母)。
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为 __。
②用铂做电极,电解H2SO4和K2SO4的混合溶液可以制备K2S2O8,其阳极的电极反应式为 __,电解过程中阴极附近溶液的pH将 __(填“增大”“减小”或“不变”)。
③产品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g产品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以 __为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-=2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该产品中K2S2O8的质量分数为(杂质不参加反应) __(列式并计算)。
已知X是二氢香豆素类化合物,是香料工业的重要化合物。X可以通过以下线路合成
请根据上图回答:
(1)D中含有的官能团名称是、;反应①属于反应。
(2)化合物B的结构简式为,
或
(3)写出反应⑤的化学方程式(有机物写结构简式,下同)
(4)化合物F 的分子式为C6H6O3,它具有酸性,F中只有两种等效氢原子,写出反应⑦的化学方程式是
(5)化合物Y是X的同分异构体,Y具有如下特点:a.苯环上有两种取代基;b.苯环是的一氯代物只有两种;c 能跟FeCl3溶液发生显色反应,且1molY能与3molNaOH发生反应。写出符合上述特点的Y的结构简式(任写一种)
实验室用乙醇制取乙烯的装置如下图,回答下列问题。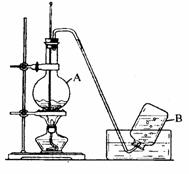
(1)仪器A的名称是;A中加入沸石的目的是;在烧杯中配制A中溶液的方法是;在反应中浓硫酸的作用是;A中发生反应的化学方程式是。
(2)A中产生的气体除乙烯外,还可能混有少量
(填化学式)
(3)用乙烯制聚乙烯的化学方程式为
(1).写出羟基分别与下列基团相结合构成物质的名称:
①—CH2CH2— ; ②CH3—— ;
②CH3—— ;
(2).① 某有机物A,其化学式为CxHyOz,它的红外吸收光谱表明有羟基O-H键和烃基上C-H键的红外吸收峰,且烃基与羟基上氢原子个数比为2:1,它的相对分子质量为62,则其结构简式为。
② 某有机物B对氢气的相对密度为29,燃烧2.9克该有机物,生成3.36升CO2气体,则B的分子式为;取0.58克B与足量银氨溶液反应,析出金属银2.16克,则B的结构简式为;写出B与新制氢氧化铜共热的化学方程式:
有以下各组物质,完成以下各组问题:
| A.氧气与臭氧 |
| B.氕与氘 |
C.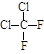 与 与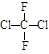 |
| D.乙烯与1-丁烯 |
E.己烷与2,3-二甲基丁烷
(1)以上各组物质属于同系物的是;属于同分异构体的是;属于同素异形体的是;属于同位素的是;属于同一物质的是。
(2)2,3-二甲基丁烷由某烯烃加成得到,则该烯烃的结构简式可能为、。
下图是实验室中制备气体或验 证气体性质的装置图
证气体性质的装置图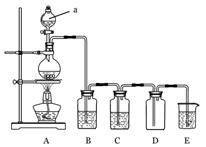
(1)仪器a的名称是_________________。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的离子方程式为_______________________________________。
②装置B中的溶液为__________________________;
烧杯中溶液的作用为________________ 。
。
(3)利用上图装置证明SO2具有漂白性、还原性及生成气体中含有CO2。
圆底烧瓶内加入碳,a中加入浓硫酸,B、D中匀为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
①证明SO2具有漂白性的装置是,现象是
②证明SO2具有还原性的现象是
③证明生成气体中含有CO2的现象是
④D装置的作用是。