研究SO2、CO等大气污染物的处理与利用具有重大意义。
Ⅰ.利用钠碱循环法可脱除烟气中SO2,该法用Na2SO3溶液作为吸收剂,吸收过程pH随n(SO)n(HSO3-)变化关系如下表:
| n(SO32-)n(HSO3-) |
91:9 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
(1)由上表判断NaHSO3水溶液显 __性,原因是 __。
(2)当吸收液呈中性时,溶液中离子浓度关系正确的是 __。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
(3)若某溶液中含3 mol Na2SO3,逐滴滴入一定量稀HCl,恰好使溶液中Cl-与HSO3-物质的量之比为21,则滴入盐酸中n(HCl)为 __mol。
Ⅱ.CO可用于合成甲醇,反应原理为
CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(4)在容积为2 L的密闭容器中通入0.2 mol CO,0.4 mol H2,达到平衡时,CO转化率为50%,则该温度下的平衡常数为 __,再加入1.0 mol CO后,重新达到平衡,CO的转化率 __(填“填大”“不变”或“减小”);平衡体系中CH3OH的体积分数 __(填“增大”“不变”或“减小”)。
(5)已知CH3OH(g)+H2O(g)=CO2(g)+3H2(g);
H2(g)+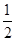 O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
有关键能数据如下:(单位:kJ/mol)
| 化学键 |
H—H |
H—O |
C—H |
C—O |
C=O |
| 键能 |
435 |
463 |
413 |
356 |
745 |
写出甲醇气体完全燃烧生成气态水的热化学方程式: __。
有机合成在现代工、农业生产中占有相当重要的地位,有机物F是一种高分子化合物,可作增塑剂,H是除草剂的中间产物,它们的合成路线如下: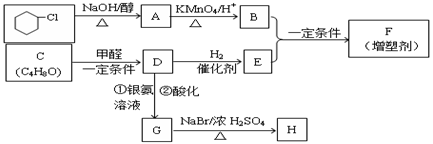
已知:
① R1CH=CHR2 R1COOH + R2COOH(R1、R2代表烃基)
R1COOH + R2COOH(R1、R2代表烃基)
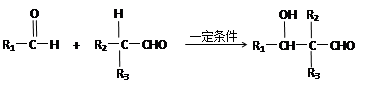 |
②
|
钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用,其中接触法制硫酸工业中就要用到V2O5作催化剂:
2SO2(g)+O2(g)  2SO3(g) ΔH<0。
2SO3(g) ΔH<0。
某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,在V2O5作催化剂下经5min反应达平衡,SO2的平衡转化率(α)为80%。
(1)5min内 v(SO3 )= mol·L-1·min-1
(2)该温度下平衡常数K=
(3)若缩小容器体积,至达到新的平衡,在图中画出反应速率变化图象。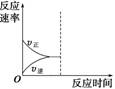
(4)硫酸工业尾气SO2用浓氨水吸收,反应的离子方程式是 ,吸收后的产物最终可制成肥料硫铵[即(NH4)2SO4]。
(5)某含钒化合物及硫酸的电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
①用该电池电解(NH4)2SO4溶液生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极电极反应式可表示为 ;若电解得1mol(NH4)2S2O8,则电池左槽中H+将 (填“增大”或“减少”) mol。
②电池使用一段时间后对其进行充电,充电过程中,阳电极反应式为: 。
已知:A、B、D为中学常见的单质,只有一种是金属,对应的元素均处在周期表中的短周期;甲、乙、丙、丁、戊、己为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,分子中不同原子的个数比为1:2,各原子最外层电子都达到稳定结构;乙是一种耐火材料;己是一种无色气体。
各物质间的转化关系如下图所示(某些条件已略去)。
请回答:
(1)单质B的组成元素在周期表中的位置是 。
(2)丁的电子式为。
(3)反应①的化学方程式为。
(4)丁的燃烧产物对环境无污染。丁—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,通入丁的电极反应式是:
,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
(5)反应②中,0.5 mol NaClO参加反应时,转移1mol 电子,其化学方程式为:
。
(6)标准状况下用排水法收集满一烧瓶己(水蒸气不计),塞上带导管的橡皮塞,通过导管向其中缓慢通入氧气,现象是: ,一段时间后,常压下不能再通入氧气,则将烧瓶倒立,导管插入盛水的水槽中,用粘冰水的毛巾冷却烧瓶,即看到烧瓶中出现“喷泉”,“喷泉”结束时,瓶中溶液的物质的量浓度是: 。(精确到小数点后三位)
用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、Mg2+、Ca2+、Cu2+等)制备氯化锌的一种流程如下。
(1) 在反应3前要将菱锌矿研磨,其目的是。
(2) 反应4将Fe2+ 氧化为Fe3+,该反应的离子方程式为。
(3) 加入氧化锌调节至pH=4.5,反应5的离子方程式为。
(4) 锌粉不在反应4之前加入的原因是。
(5) 若用石墨做电极电解滤液Y,则可以得到参与本流程反应的物质有。
有机化合物A是一种农药生产的中间体,A在一定条件下可发生下列转化: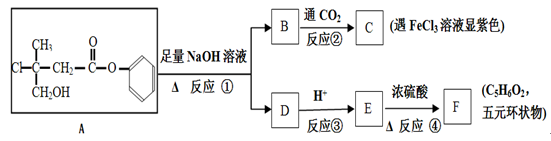
请回答下列问题:
(1)A分子中不含氧官能团的名称为。
(2)C不能发生反应的类型有(填字母)。
a.取代 b.消去 c.加成 d.氧化 e.加聚
(3)F可能的结构简式为
(4)反应①的化学方程式为。
(5)E在一定条件下反应能生成高分子化合物,其可能的结构简式为 、。