A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大。短周期元素中C的原子半径最大,B、E同族,E的最外层电子数是电子层数的2倍,A的最高价氧化物水化物为H2AO3,D是地壳中含量最高的金属元素。
(1)A的元素符号是________,C2B2的电子式为________。
(2)B、C、D、F的离子半径由大到小的顺序是________(用离子符号表示)。
(3)E和F相比,非金属性强的是________(用元素符号表示),下列事实能证明这一结论的是________(用符号填空)。
①常温下E的单质呈固态,F的单质呈气态 ②气态氢化物的稳定性:F>E ③E和F形成的化合物中,E显正价 ④F单质能与E的氢化物发生置换反应 ⑤E和F的氧化物的水化物的酸性强弱 ⑥气态氢化物的还原性:E>F
(4)把CDB2溶液蒸干所得的固体物质为________(填化学式)。
(5)C和F可组成化合物甲,用惰性电极电解甲的水溶液,电解的化学方程式为__________________________。
(6)A、B、C三种元素组成的常见化合物乙的溶液中,离子浓度由大到小的顺序为________,pH=10的乙溶液中由水电离产生的c(OH-)=________mol·L-1。
在一定条件下,乙烷和乙烯都能制备氯乙烷(C2H5Cl)。试回答:
⑴用乙烷制备氯乙烷的化学方程式是,反应类型是;
⑵用乙烯制备氯乙烷的化学方程式是,反应类型是;
⑶上述两种制备乙烷的方法中,方法好(填1或2)。原因是
____。
某温度下,在一固定容积的容器中进行如下反应N2+3H2 2NH3,下列情况一定能说明反应已达到限度的是:。(填序号)
2NH3,下列情况一定能说明反应已达到限度的是:。(填序号)
① 容器内气压不随时间变化 ② 1个N≡N键断裂的同时,有6个N—H键断裂
③用N2、H2、NH3的物质的量浓度变化表示化学反应速率的比为1:3:2。
④ 容器内气体密度不再改变 ⑤ 混合气的平均相对分子质量不随时间变化
化合物A是一种不稳定的物质,它的分子组成可用 表示,10mL A气体能分解生成15 mL
表示,10mL A气体能分解生成15 mL 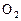 和10mL
和10mL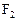 (同温同压下)
(同温同压下)
(1)A的分子式___________________;
(2)已知A分子中X个氧原子是…—O—O—O—…链状排列,则A分子的电子式____________________,结构式是_____________________。
下表是元素周期表的一部分:
族 |
I A |
II A |
III A |
IV A |
V A |
VI A |
VII A |
||
| 2 |
② |
③ |
④ |
⑤ |
⑥ |
||||
| 3 |
⑦ |
⑧ |
⑨ |
⑩ |
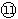 |
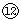 |
(1)表中元素⑩的氢化物的化学式为___________,此氢化物的还原性比元素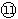 的氢化物的还原性______稳定性 (填强或弱)
的氢化物的还原性______稳定性 (填强或弱)
(2)某元素的原子结构示意图为: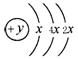 ,在周期表位于 。该
,在周期表位于 。该
氢化物沸点比甲烷 (填高或低)。
(3)用电子式表示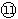 与⑧形成化合物形成过程: 。
与⑧形成化合物形成过程: 。
(4)写出⑦与⑨、⑨与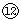 的最高价氧化物对应水化物反应的离子方程式:
的最高价氧化物对应水化物反应的离子方程式:
⑦与⑨: 、⑨与 。
。
如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
(1)电解质溶液为稀H2SO4时,灯泡_______(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题).
a.若灯泡亮,则Mg电极上发生的反应为: ____
Al电极上发生的反应为:____________
b.若灯泡不亮,其理由为:____________________________
(2)电解质溶液为NaOH(aq)时,灯泡__________
(填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题).
a.若灯泡亮,则Mg电极上发生的反应为:________
Al电极上发生的反应为:。
b.若灯泡不亮,其理由为:___________ ________。