某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴 ,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。 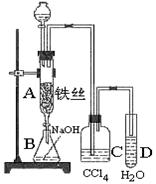
(1)写出A中反应的化学方程式 ⑵实验结束时,打开A下端的活塞,让反应液流入B中,
充分振荡,目的是 ,
写出有关反应的离子方程式 。
⑶ C中盛放CCl4的作用是 。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入 ,现象是 。
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOHB. NH3·H2O C. CuOD. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。 ( 提示: lg5 =0.7)
X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化: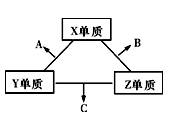
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。
请回答下列问题:
(1)X元素在周期表中的位置是
(2)①C在一定条件下反应生成A的化学方程式是
②X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。该盐的水溶液pH 7(填“大于”、“小于”、“等于”),其原因是(写出离子方程式)
下图表示几种无机物之间的转化关系,其中A、B均为黑色粉末,B为非金属单质,C为无色无毒气体,D为金属单质,E是红棕色气体,G是具有漂白性的气体,H的水溶液呈蓝色。
请回答下列问题:
(1)A的化学式是 ,C的电子式是 ,Y的名称是 。
(2)反应①的化学方程式为 。
(3)实验室测定气体E的相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示) 。
(4)19.2g的D与足量的一定浓度X的溶液反应,将所得的气体与 L O2(标准状况下)混合,恰好能被水完全吸收。
利用下图装置,写出除去下列气体中的杂质的方法,并写出化学方程式(括号内的气体为杂质)。
(1)CO2(SO2):
化学方程式:_。
(2)SO2(SO3)(假设SO3为气体):化学方程式:______________________________________________________
(3)NO(NO2):__________________________________________________。
化学方程式:_____________________________________________________。
提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空: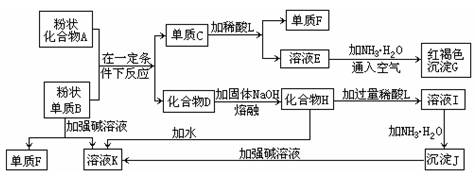
(1)单质F是_____________________。
(2)写出由E生成G的化学反应方程式或离子方程式___________________。
(3)溶液I中所含金属离子是_____________________。
(4)由C→E+F若改用浓酸,则不能选用的浓酸是(写分子式)____________________。