A、B、C是元素周期表中相邻的三种元素,其中A、B同周期,B、C同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则A、B、C分别是( )
A.Mg、Al、Si B.Li、Be、Mg
C.N、O、S D.P、S、O
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
已知25℃、101kPa时: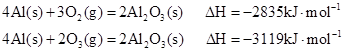
下列说法正确的是( )
| A.O3比O2稳定,由O2转化为O3是吸热反应 |
| B.O2比O3稳定,由O2转化为O3是放热反应 |
| C.等质量的O2比O3能量高,由O2转化为O3是放热反应 |
| D.等质量的O2比O3能量低,由O2转化为O3是吸热反应 |
在一定温度下,下列叙述不是可逆反应A(g)+3B(g)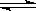 2C(g)达到平衡的标志的是()
2C(g)达到平衡的标志的是()
(1)C的生成速率与C的分解速率相等;(2)单位时间内amol A生成,同时生成3amol B;
(3)A、B、C的浓度不再变化;(4)混合气体的总压强不再变化;(5)混合气体的物质的量不再变化;(6)单位时间消耗amol A,同时生成3amol B;(7)A 、B、C的分子数目比为1:3:2。
A.(2)(5) B.(1)(3) C.(2)(7) D.(5)(6)
等质量的两份锌粉a、b分别加入到两份质量相同的过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,下列各图为产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )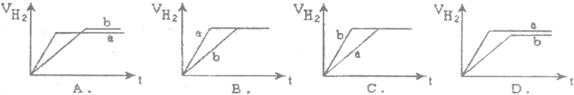
在101kPa和25°C时,有关反应的热化学方程式如下:
C(s)+1/2 O2(g)=CO(g)△H1= -110.5KJ/mol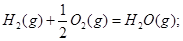
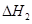 =
=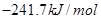
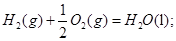
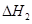 =
=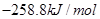
下列说法正确的是()
A.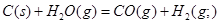 ; ;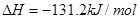 |
B.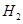 燃烧热的化学方程式为: 燃烧热的化学方程式为: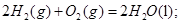 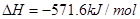 |
C.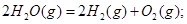 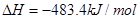 |
D.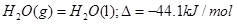 |