2g碳与水蒸气反应生成CO和H2,需吸收21.88kJ热量,此反应的热化学方程式为
| A.C + H2O ==CO + H2ΔH =+131.3kJ·mol—1 |
| B.C(s)+ H2O(g) ==CO(g) + H2(g)ΔH =+10.94kJ·mol—1 |
| C.C(s)+ H2O(g) ==CO(g) + H2(g)ΔH = -131.3kJ·mol—1 |
| D.C(s)+ H2O(g) ==CO(g) + H2(g)ΔH = +131.3kJ·mol—1 |
科学的实验方法为我们探索物质的世界提供了一把金钥匙。下列实验方法及叙述正确的是()
| A.两种互不相溶的液体,如汽油和水,不可通过分液方法分离 |
| B.因为碘易溶于酒精,所以常用酒精萃取碘水中的碘 |
| C.必须在通电时,熔融氢氧化钠才能发生电离 |
| D.能用丁达尔效应鉴别Fe(OH)3胶体和CuSO4溶液 |
下列实验设计及其对应的离子方程式均正确的是()
| A.用FeCl3溶液腐蚀铜线路板:Cu + Fe3+= Cu2+ +Fe2+ |
| B.Na与H2O反应制备H2:Na+2H2O==Na++2OH-+ H2↑ |
| C.用小苏打治疗胃酸过多:HCO3- + H+ ="=" CO2↑+ H2O |
| D.用食醋除去水瓶中的水垢: CO32- + 2H+ ="=" CO2↑+ H2O |
氮化铝(AlN)广泛应用于电子、陶瓷等工业等领域。在一定条件下,AlN可通过如下反应制取: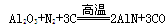 ,下列叙述正确的是 ( )
,下列叙述正确的是 ( )
| A.AlN中氮的化合价为+3 |
| B.AlN的摩尔质量为41 g |
| C.上述反应中,N2是氧化剂,Al2O3 既不是氧化剂也不是还原剂。 |
| D.上述反应中,每生成1 mol AlN需转移6 mol电子 |
常温下,在溶液中可以发生反应:X+2Y3+===2Y2++X2+,对下列叙述的判断正确的是( )
①X被氧化 ②X是氧化剂 ③X具有还原性 ④Y2+是氧化产物
⑤Y2+具有还原性 ⑥Y3+的氧化性比X2+的氧化性强
| A.②③④⑥ | B.①③④⑤ | C.①③⑤⑥ | D.①②⑤⑥ |
配制一定体积、一定物质的量浓度的溶液,下列操作会使配得的溶液浓度偏小的是()
| A.容量瓶中原有少量蒸馏水 |
| B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
| C.滴管加水时,有少量水滴到容量瓶外 |
| D.加水未达到刻度线 |