元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
| 元素代号 |
A |
B |
C |
D |
E |
| 原子半径/nm |
0.16 |
0.143 |
0.102 |
0.099 |
0.074 |
| 主要化合价 |
+2 |
+3 |
+6,-2 |
-1 |
-2 |
(1)用元素代号标出它们在元素周期表中对应的位置(以下为周期表的一部分)。
(2)B元素处于周期表中第__________周期、第________族。
(3)B的最高价氧化物对应的水化物与C的最高价氧化物对应的水化物反应的离子方程式为______________。
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是________(填化学式)。
(5)C、E形成的化合物为________(填化学式)。
中国北京曙光公司研制出了第一款具有我国完全自主知识产权的高性能CPU芯片——“龙芯”1号。
(1)“龙芯”(芯片)的主要化学成分是________。
(2)在计算机长距离联网使用的传输很快的线路,其使用的材料叫________,主要化学成分是________。
(3)如果这种埋在地下的材料裸露在碱性土壤中,结果会断路,用离子方程式说明原因 ________________________________________________________________________。
玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂由苯酚和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中________加入甲醛,且反应釜应装有________装置。
(2)玻璃纤维由玻璃拉丝得到。普通玻璃是由石英沙、________和石灰石(或长石)高温熔融而成,主要反应的化学方程式为______________________、_____________________。
(3)玻璃钢中玻璃纤维的作用是__________。玻璃钢具有________________________等优异性能(写出两点即可)。
(4)下列处理废旧热固性酚醛塑料的做法合理的是______(填字母代号)。
a.深埋
b.粉碎后用作树脂填料
c.用作燃料
d.用有机溶剂将其溶解,回收树脂
下表是部分短周期元素的原子半径及主要化合价:
| 元素代号 |
W |
R |
X |
Y |
Z |
Q |
M |
| 原子半径/nm |
0.037 |
0.186 |
0.074 |
0.075 |
0.077 |
0.150 |
0.160 |
| 主要化合价 |
+1 |
+1 |
-2 |
-3、+5 |
+2、+4 |
+3 |
+2 |
试用化学用语回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是 。
M在Z的最高价氧化物中燃烧的化学方程式。
(2)X可与W组成含18电子的化合物甲,甲的电子式为 ;R与X形成化合物乙R2X,用电子式表示乙的形成过程_____________________________
(3)写出Q与R最高价氧化物对应水化物反应的离子方程式_____________________。
(4)Y的氧化物是主要大气污染物之一,写出一种与之有关的污染现象______________。
除杂(括号内为杂质):请把所加试剂和有关离子反应方程式填在空白处。
| 试剂 |
离子方程式 |
|
| ①NaHCO3溶液(Na2CO3) |
||
| ② Fe2O3(Al2O3) |
||
| ③FeCl3溶液(FeCl2) |
||
| ④CO2(HCl) |
现有MgO和Al2O3的固体混合物,向其中加入100 mL 2 moL·L-1稀盐酸,充分反应后向溶液中逐滴加入 1 moL·L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:(已知MgO为碱性氧化物)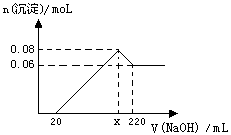
⑴NaOH溶液加至220 ml 时溶液中含有的金属元素的离子有。
⑵混合物中,MgO与Al2O3的物质的量之比为。
⑶根据以上所给数据求出 x = 。