短周期元素A、B、C、D、E、F六种元素,它们的原子序数由A到F依次增大。在周期表中,A的原子半径最小。B元素的原子最外层电子数是内层电子数的两倍,C为地壳中含量最多的元素,D是原子半径最大的短周期主族元素,D单质燃烧时呈现黄色火焰,D的单质在高温下与C的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物。D与F形成的离子化合物DF是常用的调味品。试根据以上叙述回答:
(1)元素名称:
A________、B________、C________、D________。
(2)E在元素周期表中的位置:_________________________________________________。
(3)F离子结构示意图:_____________________________________________________。
(4)A、B组成的最简单化合物的名称是____________________________________________。
(5)C、D按原子个数比1∶1组成的一种化合物与水发生反应的化学方程式为___________________________________________________________。
(6)能说明E的非金属性比F的非金属性____(填“强”或“弱”)的事实是________(举一例)。
Ⅰ、一定温度下,在容积为V L的密闭容器中进行反应:aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示: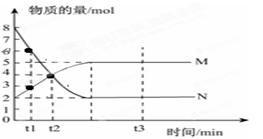
(1)此反应的化学方程式中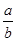 =__________
=__________
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:
(3)平衡时,N的转化率为。
(4)下列叙述中能说明上述反应达到平衡状态的是
| A.反应中M与N的物质的量之比为1︰1 |
| B.混合气体的总质量不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内每消耗a mol N,同时生成b mol M |
E.混合气体的压强不随时间的变化而变化F.N的质量分数在混合气体中保持不变
II、某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是,t2~t3速率变化的主要原因是。
(2)实验②放出氢气的量减少的原因是。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
(填“正确”或“不正确”)。请选择下列相应的a或b作答。
a、若不正确,请说明原因:
b、若正确则写出实验③中原电池的正极电极反应式。
在一容积为2L的密闭容器中加入2molA和6molB,保持温度为20℃,在催化剂存在的条件下进行下列反应:A(g)+2B(g)  2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
(1)求20℃时,该反应的平衡常数K(保留三位有效数字)
(2)20℃时,若在同一容器中加入1molA、mol B和mol C,则平衡混合气中C的体积分数仍为ω。
在一容积为2 L的密闭容器内加入0.2 molA和0.6 molB,在一定条件下发生反应:A(s)+3B(g) 2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
64.0 |
50.7 |
42.9 |
请回答下列问题:
(1)该反应的平衡常数表达式K=,ΔH0(填“>”或“<”)。
(2)1000 ℃时,4 min后达到平衡.求4 min内D的平均反应速率v(D)=,B的平衡转化率为,平衡时B的体积分数。
(3)欲提高⑵中B的平衡转化率,可采取的措施是
A.减少C的量B.增加A的量 C.移出部分D
D.降低反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)1000 ℃时, 在一容积为2 L的密闭容器内加入XmolC和0.6 molD,5 min后达到平衡,B的浓度与⑵中B的浓度相同,求X的范围
(5)下列说法中能说明反应已达到平衡状态的是
A.容器内混合气体的压强不随时间变化而变 B.B的速率不随时间的变化而变化
C.c(B)︰c(D)=1︰1 D.混合气体的密度保持不变(M(B)≠M(D))
常温下,某水溶液中存在的离子有:Na+、B2-、HB-、H+、OH-,存在的分子有H2O、H2B。根据题意回答下列问题:
(1)写出酸H2B的电离方程式﹑。
(2)常温下,已知0.1 mol·L-1二元酸H2B溶液中c(OH-) / c(H+)=1×10-6。
①常温下,0.1 mol·L-1H2B溶液的pH=;
②写出该酸(H2B)与少量NaOH溶液反应的离子方程式:;
(3)常温下,将100 mL 0.1 mol·L-1的稀H2SO4溶液与100 mL 0.4 mol·L-1的NaOH溶液充分混合(溶液体积变化忽略不计),所得溶液的pH=。
(4)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=。该温度下(t℃),0.1 mol·L-1HCl溶液的pH=;
⑴有下列物质:①铜 ②硫酸钡固体 ③氨水 ④氢氧化钠固体 ⑤熔融硝酸钾;⑥乙醇; ⑦稀硫酸; ⑧金刚石; ⑨二氧化硫 ; ⑩冰醋酸。
其中能导电的有;属于非电解质的有;属于强电解质的有;(填序号)
(2)常温下,将pH=3的盐酸和pH=11的氨水等体积混合后溶液呈性,溶液中c(NH4+)与c(Cl-)的大小关系是:c(NH4+)c(Cl-);
(3)常温下,0.010mol·L-1盐酸和0.010mol·L-1氨水的pH之和14,常温下,pH=2的盐酸和pH=12的氨水,分别加水稀释10倍后,两溶液的pH之和14(填>,<或=)
(4)用物质的量浓度为0.04 mol·L-1的盐酸恰好中和OH-浓度为1.0×10-3 mol·L-1的氨水溶液20mL,消耗盐酸12.5mL,则此氨水物质的量浓度为mol·L-1;电离度为。