用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是
| A.X为直流电源的负极,Y为直流电源的正极 |
| B.阳极区pH增大 |
| C.图中的b>a |
| D.该过程中的产品主要为H2SO4和H2 |
能正确表示下列反应的离子方程式是
| A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O |
B.氯化钠与浓硫酸混合加热:H2SO4+2Cl- SO2↑+Cl2↑+H2O SO2↑+Cl2↑+H2O |
| C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O |
| D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓ |
室温下,在0.2mol/LAl2(SO4)3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是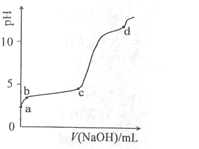
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH- Al(OH)3 Al(OH)3 |
| B.a→b段,溶液pH增大,Al3+浓度不变 |
| C.b→c段,加入的OH-主要用于生成Al(OH)3沉淀 |
| D.d点时,Al(OH)3沉淀开始溶解 |
下列物质的转化在给定条件下能实现的是
①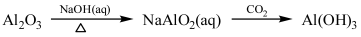
②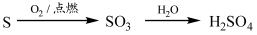
③
④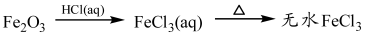
⑤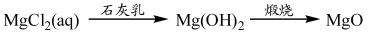
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |
下列实验的现象与对应结论均正确的是
| 选项 |
操作 |
现象 |
结论 |
| A |
将浓硫酸滴到蔗糖表面 |
固体变黑膨胀 |
浓硫酸有脱水性和强氧化性 |
| B |
常温下将Al片放入浓硝酸中 |
无明显变化 |
Al与浓硝酸不反应 |
| C |
将一小块Na放入无水乙醇中 |
产生气泡 |
Na能置换出醇羟基中的氢 |
| D |
将水蒸气通过灼热的铁粉 |
粉末变红 |
铁与水在高温下发生反应 |
下列有关物质的性质与应用不相对应的是
| A.明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| B.FeCl3溶液能与Cu 反应,可用于蚀刻印刷电路 |
| C.SO2具有氧化性,可用于漂白纸浆 |
| D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |