为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
(1)第①步Cu与混酸反应的离子方程式为______________________________。得到滤渣1的主要成分为_________________。
(2)第②步中加入H2O2的作用是__________________,使用H2O2的优点是_________;调溶液pH的目的是____________________________________。
(3)简述第③步由滤液2得到CuSO4·5H2O的方法是_________________________
____________________________________________________________ 。
(4)由滤渣2制取Al2(SO4)3·18H2O ,设计了以下三种方案:
上述三种方案中,_______方案不可行,原因是_______________________________;
从原子利用率角度考虑,_______方案更合理。
(5)用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2-→ CuY2- + 2H+。写出计算CuSO4·5H2O质量分数的表达式ω= __________________ 。
S O2与O2在催化剂作用下合成SO3的反应为:2SO2(g)+O2(g)  2SO3(g)。在容积均为1L的a、b、c、d、e五个密闭容器中均充入1molO2和2molSO2混合气体,控温。反应进行5min时,测得相关数据如下表:
2SO3(g)。在容积均为1L的a、b、c、d、e五个密闭容器中均充入1molO2和2molSO2混合气体,控温。反应进行5min时,测得相关数据如下表:
 容器温度 容器温度浓度 |
a容器 400℃ |
b容器 425℃ |
c容器 450℃ |
d容器 475℃ |
e容器 500℃ |
| c(O2) |
0.8 |
0.6 |
0.3 |
0.5 |
0.7 |
| c(SO3) |
0.4 |
0.8 |
1.4 |
1.0 |
0.6 |
(1)反应进行5min内,五个容器中平均反应速率最大的是_______________(填容器编号);
(2)计算a容器中O2的反应速率_________________;
(3)写出该反应的平衡常数表达式K=___________________,比较上表中数据,推测可能达到平衡的容器是_____________(填容器编号);
(4)该反应是________(填“放热”、“吸热”)反应,在右图坐标中画出e容器中SO3的物质的量随时间的变化
曲线。
H2O2是在医疗、化工方面应用广泛的化学试剂。
(1)Na2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,则应选择的过氧化物是________;
(2)实验室可用H2O2与次氯酸钠反应制氧气, 其中还原剂是__________,写出反应的化学方程式______________,生成0.5mol氧气,转移电子_______mol;
(3)用酸性高锰酸钾溶液滴定法可测定双氧水中H2O2的含量,有两位同学分别用以下化学方程式表示其中的反应原理:
①5H2O2+2KMnO4+3H2SO4→2MnSO4+K2SO4+5O2↑+8H2O
②3H2O2+2KMnO4+3H2SO4→2MnSO4+K2SO4+4O2↑+6H2O
你认为其中错误的是_______(认为没有可以不填),简述理由__________________。
下表为元素周期表的短周期部分。请填空。
| A |
D |
E |
|||||
| G |
J |
L |
(1)写出A原子的最外层电子的轨道表示式,G、J、L三种元素形成的简单离子中,离子半径最小的是__________;
(2)A元素可形成化合物Fe(AO)5,该物质常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(AO)5晶体属于(填晶体类型);
(3)将D元素的气态氢化物通入稀硫酸中,写出反应的离子方程式_____________________;
(4)M与E同主族且核外电子比E多三个电子层,M位于元素周期表_______周期______族,有研究显示HMO具有两性,则HMO与盐酸反应化学方程式为_________________。
A是生产某新型工程塑料的基础原料之一,由C、H、O三种元素组成,其分子结构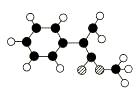
模型如图所示(图中球与球之间连线代表化学键单键或双键)。
根据分子结构模型写出A的分子式____________ ,A分子中至少有________个碳原子一定共平面,A的核磁共振氢谱有_______个吸收峰。
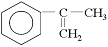
(2)以为主要原理合成A的路线如下: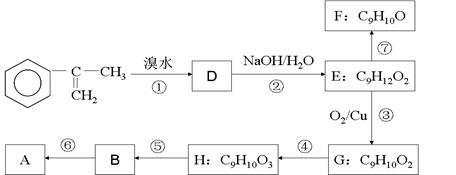
(a)A的合成路线中属于氧化反应的有__________ (填序号)
(b)H的结构简式为___________
(c)写出反应⑥的化学方程式(注明必要的条件)
______________________________________________________________________________________
(d)已知反应⑦为消去反应,有同学试图用酸性KMnO4溶液将F直接氧化成B,你认为该想法能否实现?若能,写出反应的化学方程式,若不能请说明原因。
_________________________________________________________________________________________
(e)G的某同分异构体,苯环上只有一个侧链,且能发生银镜反应和水解反应,写出其可能的结构简式
A~G为中学常见的化合物,它们之间有如图
所示的转化关系(反应条件及部分产物已略去)。A为绿色
粉末,含H、C、O、Cu四种元素。常温下D为无色无味
气体,B为黑色粉末,E能发生银镜反应。请回答:
(1)D跟G反应的化学方程式为_____________________________________; 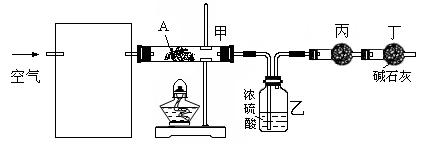
(2)F中一定含有的官能团的名称为_______________________;
(3)某课外小组同学设计了上述实验装置,通过测定某些装置中试剂的质量变化,探究A中各元素的质量关系。
① 为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
② 向装置中鼓入空气的目的是_________________________________________________________;
丙装置中药品的名称为_______________________________,实验时,该药品未见明显变化,证明_______________________________________________________________________________;
③ 如何判断A已完全分解?____________________________________________________________。
④ 更精确的测定得出如下数据:A受热后完全分解,固体由8.0 g变为6.0 g,装置乙增重0.90 g。写出A的化学式(表示为碱式盐):__________________________________________