用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol—1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ·mol—1
下列说法不正确的是:
| A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ΔH=-Q,Q>574kJ·mol—1 |
| B.等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同 |
| C.若用标准状况下4.48L CH4还原NO2至N2,放出的热量为173.4kJ |
| D.若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总物质的量为1.6mol |
25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s) △H2=-511KJ/mol
下列说法正确的是
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s) △H=-317kJ/mol |
下列说法不正确的是
| A.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 |
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α, 。若加入少量醋酸钠固体,则CH3COOH 。若加入少量醋酸钠固体,则CH3COOH CH3COO-+H+向左移动,α减小,Ka变小 CH3COO-+H+向左移动,α减小,Ka变小 |
| C.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 |
D.已知:Fe2O3(s)+3C(石墨) 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。 |
CO(g)+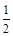 O2(g)
O2(g) CO2(g),△H=-283.0 kJ/mol。
CO2(g),△H=-283.0 kJ/mol。
C(石墨)+O2(g) CO2(g),△H=-393.5 kJ/mol。
CO2(g),△H=-393.5 kJ/mol。
则4Fe(s)+3O2(g) 2Fe2O3(s),△H=-1641.0 kJ/mol
2Fe2O3(s),△H=-1641.0 kJ/mol
下列有关说法正确的是
| A.CaCO3(s) =CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| C.N2(g)+3H2(g) =2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2 )和H2的平衡转化率均增大 |
| D.水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应 |
某反应的反应过程中能量变化如图 所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
| A.该反应为放热反应 |
| B.催化剂能改变该反应的焓变 |
| C.催化剂能降低该反应的活化能 |
| D.逆反应的活化能大于正反应的活化能 |
工业生产水煤气的反应为:C(s)+H2O(g)→CC(g)+H2(g)-131.4 kJ
下列判断正确的是
| A.反应物能量总和大于生成物能最总和 |
| B.CO(g)+H2(g)→C(s)+ H2O(l)+131.4 kJ |
| C.水煤气反应中生成1 mol H2(g)吸收l31.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |