A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素。
已知:
A为金属单质,B为红褐色固体,E为密度最小的气体,G为浅绿色的溶液。
D的水溶液为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
在水溶液中D能将某氧化物氧化为F,F是含有三种元素的化合物。
请回答下列问题:
(1)构成C物质的元素在周期表中的位置是 ,在短周期主族元素中,该元素与其相邻元素的原子半径从大到小的顺序是 (用元素符号表示)。
(2)D的水溶液呈 性,请用离子方程式解释原因: 。
(3)上述反应中属于置换反应的是 (填序号)。
(4)反应③(即D将某种氧化物氧化为F)的离子方程式: 。
(5)对气体C进行如下实验。已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023个。请按照要求填空:
| 实验步骤 |
实验现象 |
写离子方程式 |
| 将少量气体通入淀粉KI溶液 |
溶液最初变成 色 |
|
| 继续通入气体 |
溶液逐渐变成无色 |
|
醇酸树脂是一种成膜性好的树脂,下面是一种醇酸树脂的合成线路:
已知:
(1)反应①的化学方程式是。
(2)写出B的结构简式是。
(3)反应④的化学方程式为是。
(4)反应⑤的化学方程式是。
(5)下列说法正确的是(填字母)。
a.B存在顺反异构
b.1 mol E与足量的银氨溶液反应能生成2 mol Ag
c.F能与NaHCO3反应产生CO2
d.丁烷、1-丙醇和D中沸点最高的为丁烷
(6)写出符合下列条件的与 互为同分异构体的结构简式 。
互为同分异构体的结构简式 。
a.能与浓溴水反应生成白色沉淀
b.苯环上一氯代物有两种
c.能发生消去反应
A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金。
(1)E2+的核外电子排布式为。
(2)CB32-型是(用文字描述);其中心原子的杂化轨道类型为。
(3)根据等电子原理,AB分子的电子式为;其中σ键与π键之比为。
(4)[E(H2O)6]3+内E3+与H2O间的作用力为。
(5)D2C的晶胞结构与CaF2晶胞(如图)相似,则Y应为(填离子符号);D2C的熔点比CaF2熔点(填“高”、“低”或“无法比较”)。
某同学对Cl2与KI溶液的反应进行了实验探究。反应装置如下:
通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。继续通入氯气,最后溶液变为浅黄绿色。
(1)已知I2+I- I3- ,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
I3- ,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
| 操作 |
实验现象 |
|
| a |
取2~3 mL黄色溶液,加入足量CCl4, 振荡静置。 |
CCl4层呈紫红色, 水层显浅黄色。 |
| b |
取2~3 mL饱和碘水,加入足量CCl4, 振荡静置。 |
CCl4层呈紫红色,水层几近无色。 |
① 实验b的目的是。
② 根据实验a中,水层中含有的粒子有。
③ 实验a中水溶液颜色变浅的原因是。
④ 为保证实验的严谨性,在实验a、b的基础上,需补充一个实验,该实验为。
(2)通入氯气,溶液由黄色变为无色,是因为氯气将I2氧化。已知1 mol Cl2可氧化0.2 mol I2,该反应的化学方程式是。
(3) 根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为。
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+)(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH4+)。
(3)
如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是(填写字母),导致pH随温度变化的原因是;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=。
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
试分析图中a、b、c、d四个点,水的电离程度最大的是;在b点,溶液中各离子浓度由大到小的排列顺序是。
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
CH4(g)+2NO2 (g)=N2(g) + CO2(g)+2H2O(g)△H3=-867kJ·mol-1
则△H2=。
Ⅱ.化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为C(s) + H2O(g)= CO(g) + H2(g),
该反应的化学平衡常数表达式为K=。 800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应:CO(g) + H2O(g)  CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是(填符号)。
CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是(填符号)。
a加入催化剂 b降低温度c缩小容器体积 d减少CO2的量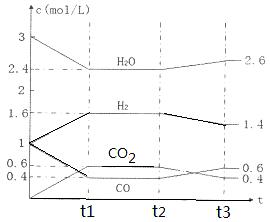
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
①用离子方程式表示反应器中发生的反应。
②用化学平衡移动的原理分析,在 HI分解反应中使用膜反应器分离出H2的目的是。
Ⅲ.开发新能源是解决大气污染的有效途径之一。甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示: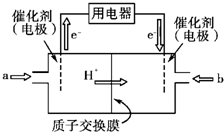
通入a气体的电极是原电池的(填“正”或“负”),
其电极反应式为。