某同学对Cl2与KI溶液的反应进行了实验探究。反应装置如下:
通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。继续通入氯气,最后溶液变为浅黄绿色。
(1)已知I2+I- I3- ,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
I3- ,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
| |
操作 |
实验现象 |
| a |
取2~3 mL黄色溶液,加入足量CCl4, 振荡静置。 |
CCl4层呈紫红色, 水层显浅黄色。 |
| b |
取2~3 mL饱和碘水,加入足量CCl4, 振荡静置。 |
CCl4层呈紫红色,水层几近无色。 |
① 实验b的目的是 。
② 根据实验a中,水层中含有的粒子有 。
③ 实验a中水溶液颜色变浅的原因是 。
④ 为保证实验的严谨性,在实验a、b的基础上,需补充一个实验,该实验为 。
(2)通入氯气,溶液由黄色变为无色,是因为氯气将I2氧化。已知1 mol Cl2可氧化0.2 mol I2,该反应的化学方程式是 。
(3) 根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为 。
在世纪之交,罗马尼亚的炼金废水汇入尼罗河,导致大量鱼类等水生物死亡,造成世界级 的水污染事件。炼金废水中含有络离子[Au(CN)2]-,它能电离出有毒的CN-,当CN-与H+结
的水污染事件。炼金废水中含有络离子[Au(CN)2]-,它能电离出有毒的CN-,当CN-与H+结 合时生成剧毒的HCN。完成下列问题:
合时生成剧毒的HCN。完成下列问题:
(1)HCN的水溶液酸性很弱,其电离方程式为_________________,NaCN的水溶液呈碱性是因为_________________(用离子方程式表示)。
(2)室温下,如果将0.1mol NaCN和0.05mol HCl全部溶于水,形成混合溶液(假设无损失),
①___和___两种粒子的物质的量之和等于0.1mol。
②___和___两种粒子的物质的量之和比H+多0.05mol。
在25℃时,用石墨电极电解2.0 L,2.5 mol/L CuSO4溶液,如有0.2 mol电子发生转移,试回答下列问题:
⑴电解后得到的Cu的质量是,得到O2的体积(标准状况)是,溶液的pH是。
⑵如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差,电解液的pH(填“变小”、“变大”或“不变”)
将等物质的量A、B气体,置于容积为2L的密闭容器中发生反应,当反应进行到8s末,达到该反应的限度,测得A的物质的量减少0.6mol,B的物质的量减少0.2mol,C的物质的量增加0.4mol,此时n(A):n(B):n(C)=1:2:1。
则:
(1)该反应的化学方程式为:;
(2)用生成物C表示的该反应的速率为:;
(3)反应前A、B的物质的量浓度是:。

(1)已知 A、B、C、D是中学化学中常见的四种不同
A、B、C、D是中学化学中常见的四种不同 微粒,它们之间存在如图所示的转化关系.如果A、B是
微粒,它们之间存在如图所示的转化关系.如果A、B是 10电子离子,C、D是10电子分子,A、B、C、D均含有
10电子离子,C、D是10电子分子,A、B、C、D均含有 两种元素.请写出A、B、C、D四种不同微粒的化学式:
两种元素.请写出A、B、C、D四种不同微粒的化学式: A、B、
A、B、 C、D.
C、D.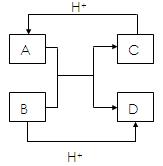
(2)现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O(B)Zn + CuCl2 = ZnCl2+ Cu
①根据两反应本质,判断能否设计成原电池(A)(B)
②如果能,实验结束后,称得两极质量差为12.9g,则转移电子的物质的量为__________.
③如果不能,说明其原因
(9分)下表为元素周期表的一部分,请回答有关问题:
| IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 4 |
⑨ |
⑩ |
(1)表中最活泼的金属是______,非金属性最强的元素是______;(填写元素符号)
(2) 最高价氧化物对应水化物酸性最强的化合物是__________;(填写分子化学式)
(3)表中能形成两性氢氧化物的元素是_______,分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的离子反应方程式:
_____________________,___________________________;
(4)比较⑦、⑩单质氧化性的强弱:__________________________。