已知某物质主要成分的化学式为XY2,X原子的结构示意图为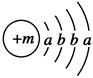 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=________,该物质主要成分的化学式为________。
(2)Z、W元素的名称为________、________。
(3)下列说法正确的是________。
| A.XY2和WZ2都为离子化合物 |
| B.XY2分子中仅含离子键,WZ2中仅含极性共价键 |
| C.H2Z比HY的稳定性强 |
| D.X的阳离子比Y的阴离子半径大 |
(4)下列化学用语表达正确的是________。
(5)水的沸点比H2Z的沸点高,其原因是_________________________________________。
燃烧2mol某有机物,生成4molCO2和6molH2O,同时消耗5molO2,则该有机物的分子式为____________________
⑴乙醇的分子结构
结构式:
结构简式:
⑵、乙醇的化学性质
①乙醇能与金属钠(活泼的金属)反应:
并完成下表。
|
金属钠 的变化 |
气体燃 烧现象 |
检验 产物 |
||||||||
| 水 |
|||||||||||
| 乙醇 |
②醇的氧化反应
乙醇燃烧化学反应方程式:
乙醇在Cu做催化剂时加热的化学方程式:
平达喜是常用的中和胃酸的药物,它的化学成分是铝和镁的碱式碳酸盐,其中氢元素的质量分数为0.040。取该碱式盐3.01g,加入2.0mol·L-1盐酸使其溶解,当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全。若在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重1.74g。试通过计算推测该碱式盐的化学式。
某有机物组成中含碳54.5%, 含氢9.1%,其余为氧,又知其蒸汽在标准状况下的密度为3.94 g/L,试求其分子式。
在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中: ① 为氯气发生装置;②的试管里盛有15mL30%KOH 溶液,并置于热水浴中; ③ 的试管里盛有15mL 8 % NaOH 溶液,并置于冰水浴中; ④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。
请填写下列空白:
(l)制取氯气时,在烧瓶里加入一定量的二氧化锰。通过_______________________
(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_____________________(填写下列编号字母)的净化装置。
| A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(2)比较制取氯酸钾和次氯酸钠的条件。二者的差异是: ___________________________
反应完毕经冷却后,② 的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是_________________(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
(3)本实验中制取次氯酸钠的离子方程式_______________________ 。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 |
原因 |
| 溶液最初从紫色逐渐变为____色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
|
| 然后溶液从无色逐渐变为____色 |