某原电池总反应离子方程式为:2Fe3++Fe=3Fe2+,不能实现该反应的原电池是( )
| A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 |
| B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3溶液 |
| C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 |
| D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液 |
下列有关说法正确的是
| A.一定条件下,使用催化剂能加快反应速率但不能改变平衡转化率 |
| B.氢氧燃料电池的能量转换形式仅为化学能转化为电能 |
| C.NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+ |
D.在一密闭容器中发生2SO2+O2 2SO3反应,增大压强,平衡会正向移动, 2SO3反应,增大压强,平衡会正向移动,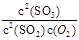 的值增大 的值增大 |
已知:CH3OH(g)+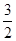 O2(g)===CO2(g)+2H2O(g) ΔH1 △S1
O2(g)===CO2(g)+2H2O(g) ΔH1 △S1
CH3OH(g)+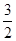 O2(g)===CO2(g)+2H2O(l) ΔH2 △S2
O2(g)===CO2(g)+2H2O(l) ΔH2 △S2
CO(g)+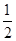 O2(g)===CO2(g) ΔH3 △S3
O2(g)===CO2(g) ΔH3 △S3
H2(g)+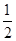 O2(g)===H2O(l) ΔH4 △S4
O2(g)===H2O(l) ΔH4 △S4
CO(g)+2H2(g)  CH3OH(g) ΔH5
CH3OH(g) ΔH5
下列关于上述反应焓变和熵变的判断正确的是
| A.△H2>0,△S2>0 | B.△H4<0,△S4<0 |
| C.△H1+△H5=△H3+2△H4 | D.△H1<△H2 |
短周期元素X、Y、Z、W的原子序数依次增大,X和Z同主族,Y和W同主族,原子半径X小于Y,四种元素原子最外层电子数之和为14。下列叙述正确的是
| A.气态氢化物的热稳定性:HnY>HnW |
| B.同周期元素中W的最高价氧化物对应水化物的酸性最强 |
| C.Y和X、Z和Y组成的常见化合物中化学键的类型相同 |
| D.原子半径的大小顺序: rW>rZ>rY>rX |
下表各组物质之间通过一步反应不可以实现如图所示转化关系的是
| 选项 |
X |
Y |
Z |
箭头上所标 数字的反应条件 |
| A |
SiO2 |
Na2SiO3 |
H2SiO3 |
①与Na2CO3熔融 |
| B |
NaCl |
NaHCO3 |
Na2CO3 |
②加热 |
| C |
N2 |
NO2 |
HNO3 |
③加热 |
| D |
C |
CO |
CO2 |
④灼热炭粉 |
下列离子方程式书写正确的是
| A.Cu与FeCl3溶液反应:Cu+ Fe3+= Cu2++ Fe2+ |
| B.FeSO4溶液和NaOH溶液反应: Fe2+ + 2OH- = Fe(OH)2↓ |
| C.碳酸钙溶于稀盐酸:CO32- + 2H+ = H2O + CO2↑ |
| D.氯气溶于水:Cl2 + H2O = 2H+ + ClO- + Cl- |