下列离子方程式书写正确的是
| A.Cu与FeCl3溶液反应:Cu+ Fe3+= Cu2++ Fe2+ |
| B.FeSO4溶液和NaOH溶液反应: Fe2+ + 2OH- = Fe(OH)2↓ |
| C.碳酸钙溶于稀盐酸:CO32- + 2H+ = H2O + CO2↑ |
| D.氯气溶于水:Cl2 + H2O = 2H+ + ClO- + Cl- |
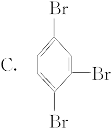
二溴苯有三种同分异构体,其中一种为M,M苯环上的氢原子被一个溴原子取代后,只能得到一种产物。则由M形成的三溴苯只能是( )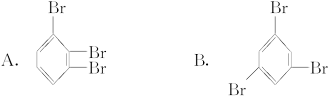
化合物中 上的—OH被卤原子取代所得化合物称为酰卤,下列化合物中可以看作酰氯的是( )
上的—OH被卤原子取代所得化合物称为酰卤,下列化合物中可以看作酰氯的是( )
| A.HCOF | B.CCl4 | C.CH3CH2Br | D.CH2ClCOOH |
下列反应的产物中,有的有同分异构体,有的没有同分异构体。其中一定不存在同分异构体的反应是( )
A.异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 |
B.2-氯丁烷( )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 |
| C.甲苯在一定条件下发生硝化生成一硝基甲苯 |
| D.溴苯在NaOH水溶液中发生水解反应 |
为了使氯乙烷的水解反应进行得比较完全,水解时需加入( )
| A.NaCl | B.NaHSO4 | C.HCl | D.NaOH |
以溴乙烷为原料制备1,2-二溴乙烷,下列方案中最合理的是( )
A.CH3CH2Br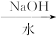 CH3CH2OH CH3CH2OH CH2==CH2 CH2==CH2 CH2BrCH2Br CH2BrCH2Br |
B.CH3CH2Br CH2BrCH2Br CH2BrCH2Br |
C.CH3CH2Br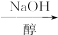 CH2==CH2 CH2==CH2 CH2BrCH3 CH2BrCH3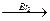 CH2BrCH2Br CH2BrCH2Br |
D.CH3CH2Br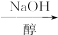 CH2==CH2 CH2==CH2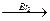 CH2BrCH2Br CH2BrCH2Br |