【实验目的】利用所学知识,设计电池装置。
【实验用品】电极:镁条、铜片、铁片等。
【电解质】果汁(橙汁、苹果汁、柠檬汁等)。
【其他】导线、金属夹、发光二极管、500 mL烧杯。
【实验方案】①Cu—Mg原电池,电解质溶液为橙汁;
②Cu—Fe原电池,电解质溶液为苹果汁;
③Fe—Mg原电池,电解质溶液为柠檬汁。
【实验操作】用导线分别将三种方案中的金属片连接到金属夹上,分别将金属片两两插入到盛有果汁的三个500 mL的烧杯中,用发光二极管两端分别接触三种方案中金属活动性不同的金属夹。观察现象,连接方式如图所示。
【实验现象】三种方案中发光二极管均发光。
【实验结论】原电池把化学能转变为电能。
回答问题:
(1)连接装置时活泼金属接二极管的________极上,较不活泼金属接二极管的________极上。
(2)在方案①②中铜作电极情况__________________________。
(3)在方案①③中镁作电极情况__________________________。
(4)在方案②③中铁作电极情况__________________________。
(5)在方案③中负极反应为______,正极反应为________,总方程式为__________________________________________________________。
火力发电厂释放出大量氮氧化合物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ/mol
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g)△H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3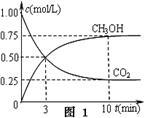
①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。回答:0~10 min内,氢气的平均反应速率为 mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 (填“正向”、“逆向”或“不”)移动。
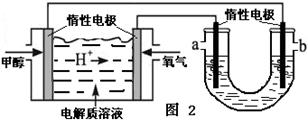
②如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL 某NaCl溶液,正极反应式为 。在电解一段时间后,NaCl溶液的pH值变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为 mol。
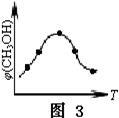
③取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H3 0(填“>”、“<”或“=”)。
(3)脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成硫酸铵。硫酸铵水溶液呈酸性的原因是 (用离子方程式表示);室温时,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+) c(NH3·H2O)。(填“>”、“<”或“=”)
(13分)工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质,并用来生产ZnSO4·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的pH如下表。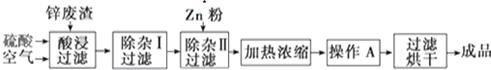
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
5.4 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
8.0 |
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有________。
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是_____。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为______。为控制上述pH范围可选择加入的试剂或药品是________。
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)在“除杂Ⅱ”步骤中,加入Zn粉的作用是_______。“操作A”的名称是_______。
(4)常温下,已知Ksp〔Cu(OH)2〕=2×10-20,某CuSO4溶液里c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于___________。
碳元素在自然界中分布很广,在地壳中其丰富程度位列第14位,远低于氧、硅、铝、铁等元素。但是,碳却是存在形式最复杂的元素,如煤、石油、天然气、动植物体、石灰石、白云石、二氧化碳等。请回答下列问题:
(1)基态碳原子的电子排布式为 。
(2)在CO2分子中,碳原子采用 杂化轨道与氧原子成键。
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键,应用价层电子对互斥理论,预测COCl2分子的空间构型为 。
(4)二茂铁(5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,实验室测定铁的含量:可用配位剂邻二氮菲(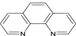 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有 个。
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有 个。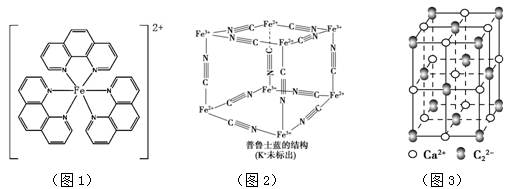
(5)普鲁士蓝可用作染料,它的结构如图2所示。
普鲁士蓝中,n(K+)∶n(Fe3+)∶n(Fe2+)∶n(CN-)= 。
(6)CaC2晶体的晶胞结构与NaCl晶体相似,但CaC2晶体中哑铃C22-的存在,使晶胞沿一个方向拉长(如图3)。CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 。
已知CaC2晶体密度为ag·cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为 cm3。
(1)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______
a.NH3 b.HIc.SO2 d.CO2
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:__________
(3)工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H = 。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。
①该电池工作时,负极是 极(填“a”或 “b”);
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为 。
(5)电解法促进橄榄石(主要成分是Mg2SiO4)固定CO2的部分工艺流程如下:
已知:Mg2SiO4(s)+4HCl(aq) 2MgCl2(aq)+SiO2 (s)+ 2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq)+SiO2 (s)+ 2H2O(l) △H =-49.04 kJ·mol-1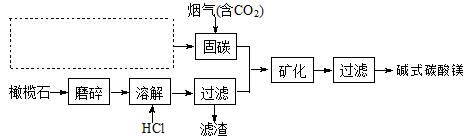
①某橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为 。
②在上图虚框内补充一步工业生产流程 。
③经分析,所得碱式碳酸镁产品中含有少量NaCl和Fe2O3。为提纯,可采取的措施依次为:对溶解后所得溶液进行除铁处理、对产品进行洗涤处理。判断产品洗净的操作是 。
Al、Fe、Cu是生活中常见的金属,也是应用最广泛的金属。请回答下列问题
(1)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式_____
向反应后的溶液中通入过量CO2,反应的离子方程式为_______________
(2)铁的复杂氧化物Fe3O4溶于稀硫酸生成两种盐,则反应的化学方程式为_________
检验反应后的溶液中存在Fe2+的具体操作是________________
纳米级Fe3O4是一种吸附剂,在溶液中可发生如下反应:Fe3O4+H2O+O2→Fe(OH)3,每转移1mol电子生成Fe(OH)3的物质的量为_________。
(3)2.50 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
Ⅰ.试确定b点时固体物质的化学式____________(要求写出必要的推理过程);
Ⅱ.取270℃所得样品,于770℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为_____________。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为__________。Ⅲ.1000℃发生反应的化学方程式为_____________。