汽车的发明与使用,是人类智慧的杰出体现,它为人们的生活和生产带来了极大的方便,同时由此引发的环境污染问题也越来越引起人们的关注。
(1)汽车排放的尾气中因含有氮的氧化物而污染大气,造成产生氮的氧化物的主要原因是( )
A.燃烧含氮化合物燃料引起的
B.燃烧含铅汽油引起的
C.是由于汽油燃烧不充分引起的
D.是汽缸中的N2被氧化生成的
(2)下列有关城市各项污染源与其造成的恶果对应关系正确的是( )
A.汽车尾气—光化学烟雾;工业废气—酸雨;工业废水—“公害病”
B.汽车尾气—酸雨;工业废气—“公害病”;工业废水—光化学烟雾
C.汽车尾气—“公害病”;工业废气—酸雨;工业废水—光化学烟雾
D.汽车尾气—光化学烟雾;工业废气—“公害病”;工业废水—酸雨
(3)一氧化氮和一氧化碳都是汽车尾气里的有害物质,它们能缓慢地发生如下反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0。现利用此反应,拟设计一种环保装置以消除汽车尾气对大气的污染。下列设计方案可以提高尾气处理效果的是________。
①选用适当的催化剂 ②提高装置的温度 ③降低装置的压强 ④在装置中装入碱石灰
A.①③ B.②④
C.①④ D.②③
(4)新型环保出租车采用LPG+汽油的双燃料系统,其尾气中的有毒气体成分较普通车型下降80%左右,缓解了汽车尾气排放给城市环境造成的污染问题。下列物质中不属于上述有害气体的是________。
A.CO2和H2 B.NO2和NO
C.CO和SO2 D.C粒和含铅化合物
(5)所谓“绿色汽车”是指使用液化石油气等无污染或污染较小的能源作燃料的汽车。绿色汽车可避免有毒的铅、苯的同系物以及稠环芳烃的排放。燃烧等质量的液化石油气(主要成分是含C3~C4的烃)与汽油相比较________。
A.前者生成的水少
B.前者消耗氧气量少
C.前者燃烧产生的热量多
D.前者产生的含碳化合物种类少
(6)为了减少大气污染,许多城市推广汽车使用清洁燃料。目前使用的清洁燃料主要有两类:一类是压缩天然气,另一类是液化石油气。这两类燃料的主要成分都是________。
A.碳水化合物 B.碳氢化合物
C.氢气 D.醇类
(原创)I.现有以下物质:①铁 ②稀硝酸 ③明矾 ④液氨 ⑤冰醋酸 ⑥蔗糖溶液 ⑦无水乙醇 ⑧熔融态的氢氧化钠⑨硫酸钡晶体 ⑩三氧化硫气体,回答下列问题(用相应物质序号填写):
(1)可以导电的有 。(2)属于强电解质的有 。
II. A、B、C、D四种溶液分别是氢氧化钡溶液、氨水、醋酸溶液、盐酸中的一种。
已知同浓度的四种溶液:①加入大小完全相同的锌粒,仅A、C中放出气体,且开始时A中冒气泡的速度快;②相同条件下,取B、D溶液进行导电性实验,发现导电能力最差的是D。回答下列问题:
(3)D溶液为 ;同浓度的四种溶液中,pH值最大的是 (填化学式) 溶液。
(4)pH值和体积均相同的A和C溶液,分别与足量且大小完全相同的锌粒反应,开始时的反应速率v(A) v(C) (填“>”、“<”或“=”,下同),最终产生气体的物质的量n(A) n(C)。
(5)等体积等浓度的氨水和盐酸混合后,所得溶液呈 (填“酸性”、“碱性”或“中性”),用离子方程式解释其原因 。
(6)0.1mol/L氨水中除水分子以外的粒子有 (填化学式)。
某实验小组依据反应 设计如图1原电池,探究pH对AsO4 氧化性的影响。测得电压与pH的关系如图2。下列有关叙述不正确的是( )
设计如图1原电池,探究pH对AsO4 氧化性的影响。测得电压与pH的关系如图2。下列有关叙述不正确的是( )
| A.调节pH可以改变反应的方向 |
| B.pH=0.68时,反应处于平衡状态 |
| C.pH=5时, 负极电极反应式为2I--2e -= I2 |
| D.pH>0.68时,氧化性I2>AsO43- |
氧化剂和还原剂在生产生活中广泛使用。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:
2KMnO4+ 16HBr = 5Br2+ 2MnBr2+ 2KBr+ 8H2O
①其中还原剂为 ,还原产物为
②若有0.8 mol还原剂被氧化,则转移电子的物质的量是
(2)双氧水H2O2可作为矿业废液消毒剂,可以消除采矿业废液中的氰化物(如KCN,其中N为﹣3价),化学方程式为:KCN+H2O2+H2O═KHCO3+A↑(已配平)
①生成物A的化学式为
②用双线桥法表示该反应中电子转移的方向和数目:
(3)古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:
NaClO+ NH3·H2O 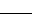 N2H4 + NaCl+ H2O
N2H4 + NaCl+ H2O
①请配平上述化学方程式
②NH3·H2O在上述反应中显示出来的性质是
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(4)人体内所含铁元素以Fe2+和Fe3+的形式存在市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为 ,但Fe2+在酸性条件下很容易被空气中的氧气氧化,写出该反应的离子方程式
实验室现有一瓶2%氢氧化钠溶液(ρ="1.22" g/mL)。
(1)该氢氧化钠溶液的物质的量浓度为
(2)由于实验需要,现还需该浓度氢氧化钠溶液230 mL,需要临时配制。
①应选择 mL的容量瓶,容量瓶使用时第一步操作是
②需要的玻璃仪器除了容量瓶、量筒外,还有
③用托盘天平称取 g NaOH
④经过测定,某同学配制的氢氧化钠浓度偏高,则可能的原因是
| A.容量瓶中残存少量蒸馏水 |
| B.称取NaOH固体时,直接在纸片上称取 |
| C.溶解的NaOH溶液未冷却到室温,就转移到容量瓶中并定容 |
| D.洗涤烧杯内壁后将洗涤液弃去 |
E.定容时,俯视容量瓶刻度线
F.定容、摇匀后发现溶液的凹液面低于刻度线
(3)取该氢氧化钠溶液20 mL,加入0.5 mol/L硫酸溶液10 mL,然后把混合溶液稀释至100 mL,则稀释后的溶液中OH﹣的浓度为
A、B、C、D为四种可溶性的盐,它们包含的阳离子和阴离子分别为Ba2+、Ag+、Na+、Cu2+和NO3﹣、SO42﹣、Cl﹣、CO32﹣(离子在物质中不能重复出现)。
①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色;
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出.根据①②实验事实可推断它们的化学式为:
(1)A B
(2)写出盐酸与D反应的离子方程式:
(3)将含相同物质的量A、B、C的溶液混合后,写出溶液中存在的离子及物质的量之比 ;在此溶液中加入锌粒,写出发生反应的离子方程式
(4)C溶液中阴离子的检验方法: